1. Công thức cấu tạo
Phân tử carbon monoxide có cấu hình electron:
hay cấu tạo:
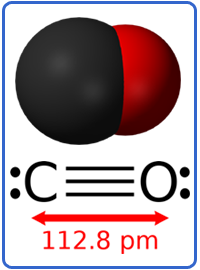 Bởi vậy liên kết C-O có năng lượng rất lớn, 1070 kJ/mol lớn nhất trong tất cả các liên kết, độ dài bé 112,8 pm và momen lưỡng cực của phân tử là không đáng kể, = 0,118D.
Bởi vậy liên kết C-O có năng lượng rất lớn, 1070 kJ/mol lớn nhất trong tất cả các liên kết, độ dài bé 112,8 pm và momen lưỡng cực của phân tử là không đáng kể, = 0,118D.
Carbon monoxide có khối lượng phân tử, tổng số electron và cấu tạo phân tử giống nito nên có một số tính chất lí hóa giống với nito.
giống nito, CO là khí không màu, không mùi, khó hóa lỏng, nhiệt độ số là -191,5oC, khó hóa rắn (nhiệt độ nóng chảy là -204oC) và ít tan trong nước. Nó rất bền với nhiệt, ở 6000oC chưa phân hủy.
giống Nito, CO kém hoạt động ở nhiệt độ thường nhưng khác nito, ở nhiệt độ cao khả năng khử tăng lên mạnh có lẽ do sự biến đổi kiến trúc electron bền của phân tử.
Ở khoảng 700oC, carbon monoxide cháy trong không khí cho ngọn lửa màu lam và phát nhiệt nhiều nên hỗn hợp của CO và O2 cũng là hỗn hợp nổ giống như hỗn hợp của H2 và O2:
2CO + O2 = 2CO2
Do phản ứng phát ra nhiều nhiệt, khí CO được dùng làm nhiên liệu. Những nhiên liệu khí thông dụng như khí than, khí lò ga và khí hỗn hợp đều chứa khí CO. Phản ứng cháy của CO trong không khí chỉ xảy ra khi có mặt những vết nước. Ở nhiệt độ thường, CO không tương tác với oxi. Nhưng tương tác đó xảy ra ở trên bề mặt của một số chất xúc tác, ví dụ như hỗn hợp MnO2 và CuO
Ở 500oC và trong bóng tối, CO tương tác với clo tạo thành photgen
CO + Cl2 = COCl2
nếu được chiếu sáng, phản ứng này xảy ra ở nhiệt độ thường. Chính tên gọi photgen (phos là ánh sáng, gen là sinh ra) nói lên đặc điểm của phản ứng tạo thành chất đó. Ngày nay để nâng cao hiệu suất phản ứng, người ta dùng thêm than hoạt tính làm chất xúc tác. Photgen dễ điều chế như vậy lại hết sức độc và nặng hơn không khí cho nên đã được dùng làm bom hơi ngạt trong chiến tranh thế giới lần thứ nhất. Về mặt hóa học, photgen khá hoạt động nên được dùng nhiều trong tổng hợp hữu cơ. Bởi vậy, ngày nay photgen được sản xuất những lượng lớn trong công nghiệp.
Carbon monoxide có thể khử được oxide của một số kim loại, Ví dụ như phản ứng xảy ra ở trong lò cao:
Fe2O3 + 3CO = 2Fe + 3CO2
CO khử được I2O5 đến I2:
I2O5 + 5CO = I2 + 5CO2
Đây là phản dùng để định lượng khí CO trong hóa học phân tích.
Ở trong dung dịch, khí CO có thể khử được muối của các kim loại quý như vàng, platin, paladi đến kim loại tự do.
Ví dụ: PdCl2 + H2O + CO = Pd + 2HCl + CO2
Nhờ phản ứng này, người ta phát hiện được những vết khí CO ở trong hỗn hợp khí: những hạt rất nhỏ của paladi tách ra trong dung dịch làm cho màu đỏ của dung dịch PdCl2 trở nên đậm hơn.
Nhưng tương tác của CO với các chất oxi hóa khác ở trong dung dịch thường chỉ xảy ra khi có mặt chất xúc tác, ví dụ như nó khử KMnO4 khi có mặt bột mịn của bạc kim loại, khử K2Cr2O7 khi có mặt muối thủy ngân.
Trong khí xả của oto có các khí CO, hidrocabon chưa cháy hết và NO. Khí NO không phải là sản phẩm của phản ứng đốt cháy nhiên liệu mà sinh ra bởi tác dụng giữa N2 và O2 của không khí ở nhiệt độ cao trong động cơ ô tô. Các khí CO và NO đều độc hại đối với người. Để bảo vệ môi trường trong sạch của không khí ở các đô thị, người ta lắp vào ô tô, ở giữa động cơ và ống xảm một thiết bị được gọi là thiết bị chuyển hóa có xúc tác. Thiết bị gồm có những tầng kiểu tổ ong làm bằng kim loại, bề mặt kim loại được phủ lớp chất xúc tác gồm có Pt, Pd và Al2O3 . Qua thiết bị, những khí độc hại được chuyển hóa thành khí vô hại.
2CO + 2NO = 2CO2 + 2N2
Điều kiện quan trọng để bảo vệ cho hoạt tính của chất xúc tác là oto phải chạy bằng etxang không chứa chì vì chì là chất độc cho chất xúc tác.
Nói chung về khả năng khử, CO tương đương với Hidro phân tử.
Dưới 830oC, CO khử mạnh hơn và trên 830oC, H2 khử mạnh hơn. Theo nguyên lí Lơ satolie chúng ta hiểu dễ dàng sự chuyển dịch cân bằng như vậy khi nhiệt độ tăng.
Tuy nhiên, khi tương tác với hidro, CO có thể tạo nên các sản phẩm khác nhau tùy theo các đk khác nhau.
Ở 300oC và có niken xúc tác, CO tương tác với hidro tạo nên metan
CO + 3H2 = CH4 + H2O
Trong những đk thích hợp về nhiệt độ, áp suất và chất xúc tác (Fe, Co, Ni, Ru..)

.jpg)
.jpg)




.jpg)
.jpg)




















