1. Cấu trúc của benzen
Công thức phân tử của benzen được xác định là C6H6 dựa vào việc xác định phân tử khối và phân tích nguyên tố. Năm 1858, Kekule đã cho rằng các nguyên tử Cacbon có thể kết hợp với nhau để tạo thành mạch. Sau đó vài năm 1865, ông bổ sung thêm là mạch cacbon cũng có thể đóng thành vòng, Ông đưa ra cấu trúc của benzen như sau:
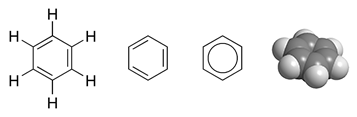
Đó là một vòng 6 cạnh gồm 3 liên kết đơn và 3 liên kết đôi nằm xen kẽ nhau (hay được gọi là Công thức Kekule)
2. Đồng phân và danh pháp
a. Đồng phân
Khi benzen có từ 2 nhóm thế trở lên sẽ có các đồng phân về vị trí tương đối giữa các nhóm thế với nhau. Chẳng hạn, ddimetylbezeen có các đồng phân 1,1-;1,2- và 1,3-dimetylbenzen hoặc còn được gọi là các đồng phân ortho-,meta- và para-dimetylbenzen
b. Danh pháp
Tên bezen là tên riêng được IUPAC lưu dùng và là hidrua nền để gọi tên các đồng đẵng và dẫn xuất khác theo danh pháp thay thế. Nhiều ankyl và ankenylbezen có tên riêng (Tên thường).
3. Tính chất vật lý
Benzen và các đồng đẳng có 1, 2, 3 nhóm thế R nhỏ thường ở trạng thái lỏng, không màu, có mùi thơm dễ chịu nhưng lại gây độc cho cơ thể. Chúng dễ bay hơi nên dễ bắt lửa, cháy với ngọn lửa sáng, khói đen do có nhiều muội than. Các aren loại này không tan trong nước và nhẹ hơn nước. Điểm sôi của chúng hầu như tăng đều đặn theo khối lượng phân tử, còn điểm nóng chảy phụ thuộc nhiều vào tính đối xứng của phân tử.
4. Tính chất hóa học
Do cấu trúc của benzen nên phản ứng đặc trưng của nó là sự thế electronphin vào nhân thơm, còn phản ứng cộng và oxi hóa có thể xảy ra nhưng với điều kiện thật nghiêm ngặt. Đồng đẳng của benzen ngoài phản ứng thế ở nhân thơm còn có phản ứng đặc trưng đối với nhóm ankyl: phản ứng thế gốc và phản ứng oxi hóa.
a. Phản ứng thế
Benzen phản ứng thế với halogen(X2) khi có sắt hoặc axit Lewis (AlCl3) tạo phenyl halogenua (C6H5X), phản ứng với axit nitric đặc có xúc tác axit sulfuric đậm đặc tạo nitro benzen (trong điều kiện ngặt nghèo hơn - axit bốc khói và nhiệt độ cao - sinh ra TNB), phản ứng với axit sulfuric đậm đặc chưng cất nước thành axit benzosulfonic.
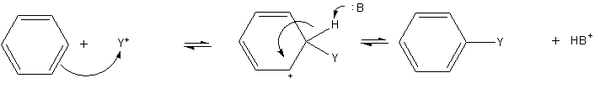
b. Phản ứng cộng
Benzen trong điều kiện có xúc tác niken, nhiệt độ cao cộng với khí hiđrô tạo ra xiclohexan. Khi có chiếu sáng, benzen tác dụng với khí clo tạo ra hexacloran C6H6Cl6 (còn gọi là thuốc trừ sâu ba số 6, thuốc trừ sâu 6-6-6), một thuốc trừ sâu hoạt tính rất mạnh, đã bị cấm.
5. Ứng dụng
Ngày nay một lượng lớn benzen chủ yếu để:
- Sản xuất styren cho tổng hợp polymer.
- Sản xuất cumen cho việc sản xuất cùng lúc axeton và phenol.
- Sản xuất cyclohexan tổng hợp tơ nilon.
- Làm dung môi, sản xuất dược liệu.
6. Điều chế
- Trùng hợp Axetilen
3CH=CH —> C6H6
- Dùng Axit Benzoic
Cho axit benzoic tác dụng với natri hidroxit theo phản ứng:
C6H5COOH + NaOH —>C6H6 + Na2CO3

.jpg)
.jpg)




.jpg)
.jpg)




















