I. TÍNH CHẤT VẬT LÝ
Nhôm là kim loại màu trắng bạc, có ánh kim, nhẹ (khối lượng riêng là 2,7 g/cm3 ), dẫn điện, dẫn nhiệt tốt, nóng chảy ở nhiệt độ 660oC. Độ dẫn điện của nhóm bằng 2/3 độ dẫn điện của đồng. Nhôm có tính dẻo nên có thể cán mỏng hoặc kéo thành sợi.
II. TÍNH CHẤT HOÁ HỌC
1. Nhôm có những tính chất hoá học của kim loại không?
a) Phản ứng của nhôm với phi kim
- Phản ứng của nhôm với oxi: Rắc bột nhôm lên ngọn lửa đèn cồn
Hiện tượng: Nhôm cháy sáng trong oxi
Giải thích: Al2O3 mỏng, bền trong không khí
4Al + 3O2 -> 2Al2O3
- Phản ứng của nhôm với phi kim khác
Nhôm phản ứng với nhiều phi kim khác như S, Cl2 tạo thành muối Al2S3, AlCl3
Hiện tượng: Nhôm tác dụng với khí Clo tạo thành muối nhôm clorua
Giải thích: Nhôm phản ứng với oxi tạo thành oxít và phản ứng với nhiều phi kim khác như S,Cl.. tạo thành muối
2Al + 3Cl2 -> 2AlCl3
b) Phản ứng của nhôm với dung dịch axit
Nhôm phản ứng với một số dung dịch axit Hcl, H2SO4 loãng...giải phóng khí H2. Thí dụ:
2Al + 6HCl -> 2AlCl3 +3H2
Chú ý: Nhôm không tác dụng với H2SO4 đặc nguội và HNO3 đặc, nguội
c) Phản ứng của nhôm với dung dịch muối
Cho một dây nhôm vào dung dịch CuCl2
Hiện tượng: Có lớp kim loại màu nâu đỏ bám lên trên miếng nhôm
Giải thích: Lớp kim loại màu nâu đỏ là Cu
2Al+3CuCl2 → 2AlCl3 +3Cu
Nhôm phản ứng được với nhiều dd muối của những kim loại hoạt động hoá học yếu hơn tạo ra muối nhôm và kim loại mới
Kết luận: Nhôm có tính chất hóa học của kim loại.
2. Nhôm có tính chất hóa học nào khác
Cho dây nhôm vào ống nghiệm đựng dung dịch NaOH
Hiện tượng: Có khí không màu thoát ra, nhôm tan dần.
Nhận xét: Nhôm có phản ứng với dung dịch kiềm.
III. ỨNG DỤNG
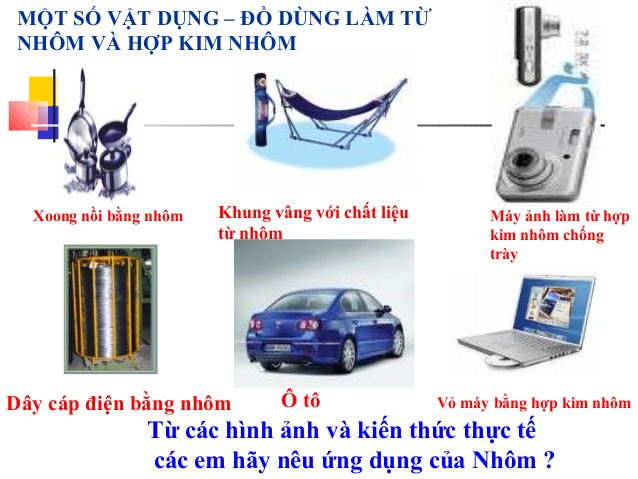
Nhôm và hợp kim nhôm được sử dụng rộng rãi trong đời sông như: đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng...
Kim loại này được dùng để tạo thành vỏ máy bay do độ bền chắc và mỏng nhẹ của nó. Nhôm cũng được dùng để sản xuất các thiết bị và dụng cụ sinh hoạt như nồi, chảo, các đường dây tải điện, các loại cửa,…
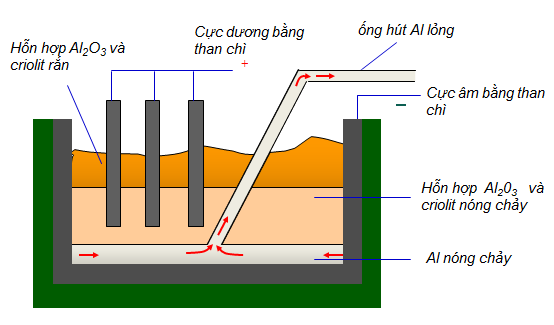
IV. SẢN XUẤT NHÔM
Hiện nay, cách điều chế chủ yếu nhất là tách nhôm trong quặng boxit nhôm có lẫn SiO2 và Fe2O3.
Trước tiên, người ta sẽ làm sạch nguyên liệu bằng cách cho phản ứng với dung dịch kiềm để tách riêng Al2O3. Sau đó dùng bình điện phân, điện phân nóng chảy Al2O3 có mặt criolit Na3AlF6. Để thực hiện việc này, ta cần hạ nhiệt độ nóng chảy tử 2050 xuống 900oC để tạo thành nhiều ion ngăn không cho oxi phản ứng lại với nhôm để tạo ra lớp oxit bảo vệ.
1. Nhôm là kim loại nhẹ, dẻo, dẫn điện, dẫn nhiệt tốt.
2. Nhôm có những tinh chất hoá học của kim loại như : tác dụng với phi kim, dụng dịch axit (trừ HNO3 đặc nguội, H2SO4 đặc nguội), dung dịch muối của kim loại kém hoạt động hơn. Nhôm có phản ứng với dung dịch kiềm.
3. Nhôm và hợp kim nhôm có nhiều ứng dụng trong công nghiệp và trong đời sống.
4, Nhôm được sản xuất bằng cách điện phân hỗn hợp nóng chảy của nhôm oxit và

.jpg)
.jpg)




.jpg)
.jpg)




















