I - TÍNH CHẤT VẬT LÍ
Ở điều kiện bình thường, clo là chất khí màu vàng lục, mùi xốc, nặng hơn không khí 2,5 lần (d=71/29≈2,5). Dưới áp suất thường, clo hóa lỏng ở −33,6oC và hóa rắn ở −101,0oC; clo rất dễ hóa lỏng ở áp suất cao.
Khí clo hòa tan vừa phải trong nước (ở 20oC,1lít nước hòa tan khoảng 2,5lít khí clo). Dung dịch clo trong nước gọi là nước clo có màu vàng nhạt. Khi để lâu, nước clo bị biến đổi do phản ứng của clo với nước (xem phần II). Clo tan nhiều trong dung môi hữu cơ, nhất là hexan và cacbon tetraclorua.
Khí clo rất độc, nó phá hoại niêm mạc đường hô hấp. Cần phải cẩn thận khi tiếp xúc với khí clo.
II - TÍNH CHẤT HÓA HỌC
Nguyên tử clo rất dễ thu một electron để trở thành anion Cl− có cấu hình electron giống khí hiếm agon:
Cl+ 1e → Cl−
...3s23p5 ...3s23p6
Clo có độ âm điện lớn, chỉ đứng sau flo và oxi, vì vậy trong hợp chất với các nguyên tố này clo có số oxi hóa dương (+1,+3,+5,+7) còn trong hợp chất với các nguyên tố khác clo có số oxi hóa âm (−1).
Do vậy, clo là phi kim rất hoạt động, là chất oxi hóa mạnh. Trong một số phản ứng, clo cũng thể hiện tính khử.
Những phản ứng dưới đây sẽ minh họa nhận xét trên.
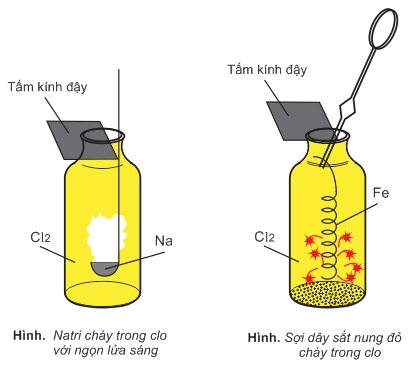
1. Tác dụng với kim loại
Clo oxi hóa được hầu hết các kim loại. Phản ứng xảy ra với tốc độ nhanh, tỏa nhiều nhiệt:
2Na + Cl2 → 2NaCl
2Fe + 3Cl2 → 2FeCl3
2. Tác dụng với hiđro
Ở nhiệt độ thường và trong bóng tối, clo oxi hóa chậm hiđro. Nhưng nếu được chiếu sáng mạnh hoặc hơ nóng, phản ứng xảy ra nhanh. Nếu tỉ lệ số mol H2:Cl2=1:1 thì hỗn hợp sẽ nổ mạnh:
H2 + Cl2 → 2HCl ;ΔH=−184,6kJ
3. Tác dụng với nước và với dung dịch kiềm
Khi tan vào nước, một phần clo tác dụng chậm với nước theo phản ứng thuận nghịch.
Axit hipoclorơ có tính oxi hóa rất mạnh, nó phá hủy các chất màu, vì thế clo ẩm có tác dụng tẩy màu.
Với dung dịch kiềm, clo phản ứng dễ dàng hơn tạo thành dung dịch hỗn hợp muối của các axit HCl và HClO :
Cl2 + 2NaOH → NaCl + NaClO + H2O
Trong các phản ứng trên, nguyên tố clo vừa là chất oxi hóa, vừa là chất khử. Đó là những phản ứng tự oxi hóa - khử.
4. Tác dụng với muối của các halogen khác
Clo không oxi hóa được ion F− trong các muối florua nhưng oxi hóa dễ dàng ion Br− trong dung dịch muối bromua và ion I− trong dung dịch muối iotua:
.png)
Điều này chứng minh trong nhóm halogen, tính oxi hóa của clo mạnh hơn brom và iot.
5. Tác dụng với các chất khử khác
Clo oxi hóa được nhiều chất. Thí dụ:
.png)
III - ỨNG DỤNG
Clo được dùng để sát trùng nước trong hệ thống cung cấp nước sạch, khi xử lí nước thải. Clo cũng dùng để tẩy trắng sợi, vải, giấy. Những ứng dụng này tiêu thụ khoảng 20% lượng clo được sản xuất.
Clo là nguyên liệu để sản xuất nhiều hợp chất nhiều hợp chất vô cơ và hữu cơ. Nó được dùng để sản xuất axit clohiđric, clorua vôi,...Gần 70% lượng clo được dùng trong sản xuất các hóa chất hữu cơ. Những sản phẩm hữu cơ chứa clo ý nghĩa lớn. Những dung môi như đicloetan, cacbon tetraclorua được dùng rộng rãi để chiết chất béo, khử dầu mỡ trên kim loại. Một số chất hữu cơ chứa clo được dùng làm thuốc diệt côn trùng bảo vệ thực vật. Từ những sản phẩm hữu cơ chứa clo, người ta chế tạo được nhiều chất dẻo, sợi tổng hợp, cao su tổng hợp, da giả,...
Hiện nay, clo cùng với axit sunfuric, amoniac, xôđa,...được xếp vào số những sản phẩm quan trọng nhất do công nghiệp hóa chất sản xuất.
IV - TRẠNG THÁI TỰ NHIÊN
Về trữ lượng trong lớp vỏ trái đất, clo đứng thứ 11 trong tất cả các nguyên tố hóa học và đứng nhất trong các halogen. Trong tự nhiên, nguyên tố clo gồm các đồng vị bền 3517Cl(75,77%) và 3717Cl(24,23%) nên có nguyên tử khối trung bình là 35,5.
Do hoạt động hóa học mạnh, clo chỉ tồn tại trong tự nhiên ở dạng hợp chất, chủ yếu là muối clorua. Hợp chất tự nhiên quan trọng nhất của clo là natri clorua. Khối lượng chủ yếu của natri clorua chứa trong nước biển và đại dương (1lít nước biển có khoảng 30gamNaCl ). Natri clorua còn được thấy ở dạng rắn gọi là muối mỏ. Kali clorua cũng khá phổ biến trong tự nhiên, có trong khoáng vật như cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.
V - ĐIỀU CHẾ
Nguyên tắc điều chế clo là oxi hóa ion Cl− thành Cl2.
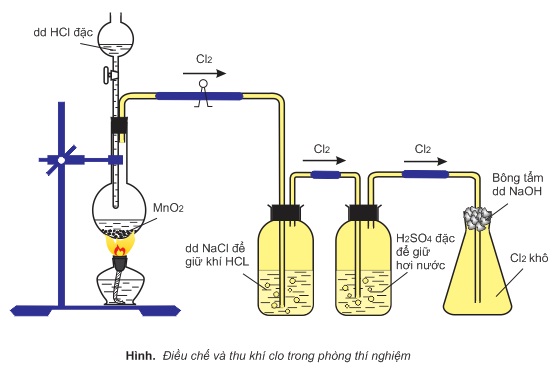
1. Trong phòng thí nghiệm
Clo được điều chế từ axit clohiđric đặc. Để oxi hóa ion Cl−, cần chất oxi hóa mạnh như MnO2,KMnO4,KClO3,..
.png)
Nếu chất oxi hóa là MnO2 thì cần phải đun nóng, còn chất oxi hóa là KMnO4 hoặc KClO3 phản ứng xảy ra ở nhiệt độ thường.
2. Trong công nghiệp
Clo được sản xuất bằng phương pháp điện phân dung dịch natri clorua bão hòa có màng ngăn. Trong bình điện phân, nhờ tác dụng của dòng điện một chiều ion Cl− bị oxi hóa thành Cl2 thoát ra ở cực dương (anot), còn ở cực âm (catot) nước bị khử, người ta thu được khí H2 và dung dịch NaOH. Cần có một màng ngăn xốp giữa hai điện cực để khí clo không tiếp xúc với dung dịch NaOH. Phương trình điện phân có thể viết như sau:
.png)
Trong công nghiệp, clo được sản xuất như là một sản phẩm phụ của công nghiệp sản xuất xút bằng điện phân dung dịch NaCl có màng ngăn.

.jpg)
.jpg)




.jpg)
.jpg)




















