I- VỊ TRÍ VÀ CẤU TẠO
1. Vị trí của nhôm trong bảng tuần hoàn
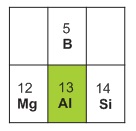
Nhôm là nguyên tố hóa học có số hiệu nguyên tử 13, thuộc nhóm IIIA, chu kì 3. Trong nhóm, nhôm đứng dưới nguyên tố phi kim bo (B). Trong chu kì, nhôm đứng sau nguyên tố kim loại magie (Mg) và trước nguyên tố phi kim silic (Si).
2. Cấu tạo của nhôm
Cấu hình electron nguyên tử: Nhôm có bán kính nguyên tử (0,125nm) nhỏ hơn nguyên tử Mg(0,16nm). Nguyên tử nhôm có 13e được phân bố như sau: 1s22s22p63s23p1, trong đó có 3e hóa trị (3s23p1). Ion Al3+ có cấu hình elcetron của nguyên tử khí hiếm Ne:
Al→Al3++3e
[Ne]3s23p1 [Ne]
Al là nguyên tố p.
Năng lượng ion hóa: so sánh năng lượng ion hóa I3 với I2 của nguyên tử nhôm ta thấy I3:I2=2744:1816=1,5:1
Như vậy, năng lượng ion hóa I3 chỉ lớn hơn năng lượng ion hóa I2 có 1,5 lần.
Do vậy khi cung cấp năng lượng cho nguyên tử Al sẽ có 3e tách ra khỏi nguyên tử.
Độ âm điện: Nguyên tử Al có giá trị âm điện là 1,61
Số oxi hóa: Trong hợp chất, nguyên tố Al có số oxi hóa bền là +3
Mạng tinh thể: Nhôm có cấu tạo kiểu mạng lập phương tâm diện.
II- TÍNH CHẤT VẬT LÍ
Nhôm là kim loại màu trắng bạc, mềm, dễ kéo sợi và dát mỏng. Có thẻ dát được lá nhôm mỏng 0,01mm dùng để gói thực phẩm.
Nhôm là kim loại nhẹ (2,7g/cm3), nóng chảy ở nhiệt độ 660oC
Nhôm dẫn điện và dẫn nhiệt tốt. Độ dẫn nhiệt bằng 2/3 đồng nhưng lại nhẹ hơn đồng 3 lần. Độ dẫn điện của nhôm hơn sắt 3 lần.
III- TÍNH CHẤT HÓA HỌC
Nhôm có thế điện cực chuẩn nhỏ hơn so với nhiều kim loại khác E0Al3+/Al=−1,66V
Nguyên tử nhôm có năng lượng ion hóa thấp. Do vậy nhôm là kim loại có tính khử mạnh. Tuy nhiên tính khử của nhôm yếu hơn các kim loại kiềm và kim loại kiềm thổ. Tính khử mạnh của nhôm được thể hiện qua những phản ứng hóa học sau:
1. Tác dụng với phi kim
Nhôm tác dụng trực tiếp và mạnh với nhiều phi kim như O2,Cl2,S,...
Thí dụ: Khi đốt nóng, bột nhôm cháy sáng trong không khí. Phản ứng tỏa nhiều nhiệt.
4Al+3O2→to 2Al2O3
Nhôm bền trong không khí ở nhiệt độ thường do có màng oxit Al2O3 rất mỏng, mịn và bền chắc bảo vệ.
Bột nhôm tự bốc cháy khi tiếp xúc với khí clo:
2Al+3Cl2→2AlCl3
2. Tác dụng với axit
Thế điện cực chuẩn của nhôm (E0Al3+/Al=−1,66V) nhỏ nên kim loại nhôm khử dễ dàng ion H+ của dung dịch axit, như HCl và H2SO4 loãng, giải phóng H2:
2Al+6HCl→2AlCl3+3H2↑
2Al+6H+→2Al3++3H2↑
Nhôm khử N+5 trong HNO3 ở dung dịch loãng hoặc đặc, nóng và S+6 trong H2SO4 ở dung dịch đặc, nóng xuống số oxi hóa thấp hơn:
Al+4HNO3 loãng→to Al(NO3)3+NO+2H2O
2Al+6H2SO4 đặc→to Al2(SO4)3+3SO2+6H2O
Nhôm không tác dụng với H2SO4 và HNO3 đặc, nguội. Những axit này đã oxi hóa bề mặt kim loại tạo thành một màng oxit có tính trơ, làm cho nhôm thụ động. Nhôm bị thụ động sẽ không tác dụng với các dung dịch HCl,H2SO4 loãng.
3. Tác dụng với oxit kim loại
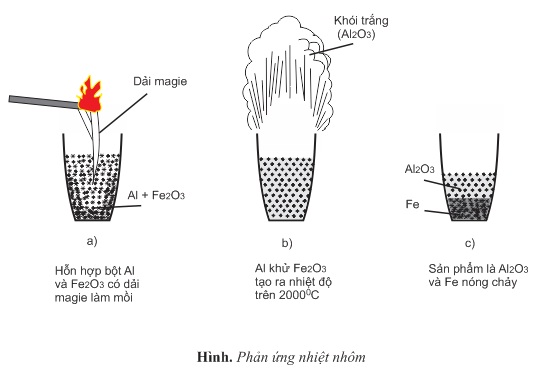
Ở nhiệt độ cao, Al khử được nhiều oxit kim loại như Fe2O3,Cr2O3,... thành kim loại tự do.
Thí dụ:
2Al+Fe2O3→to Al2O3+2Fe
Phản ứng của Al với oxit kim loại gọi là phản ứng nhiệt nhôm. Nhiệt lượng do phản ứng tỏa ra làm nóng chảy các kim loại.
4. Tác dụng với nước
Thế điện cực của hiđro ở pH=7(E0H2O/H2=−0,41V) cao hơn so với thế điện cực chuẩn của nhôm (E0Al3+/Al) nên nhôm có thể khử được nước, giải phóng khí hiđro:
2Al+6H2O→2Al(OH)3↓+3H2↑
Phản ứng trên nhanh chóng dừng lại vì lớp Al(OH)3 không tan trong nước đã ngăn cản không cho nhôm tiếp xúc với nước.
Vì sao những vật bằng nhôm hằng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng ?
Đó là do trên bề mặt của vật được phủ kín bằng màng Al2O3 rất mỏng (không dày hơn 10−5mm) rất mịn và bền chắc đã không cho nước và khí thấm qua.
5. Tác dụng với dung dịch kiềm
Những đồ vật bằng nhôm bị hòa tan trong dung dịch kiềm như NaOH,Ca(OH)2,...Hiện tượng này được giải thích như sau:
Trước hết, màng bảo vệ là Al2O3 bị phá hủy trong dung dịch kiềm:
Al2O3+2NaOH+3H2O→2Na[Al(OH)4](1)
Natri aluminat
Tiếp đến, kim loại nhôm khử H2O:
2Al+6H2O→2Al(OH)3+3H2↑(2)
Màng Al(OH)3 bị phá hủy trong dung dịch bazơ:
Al(OH)3+NaOH→Na[Al(OH)4](3)
Các phản ứng (2) và (3) xảy ra luân phiên nhau cho đến khi nhôm bị tan hết. Hai phương trình hóa học của hai phản ứng trên có thể viết gộp vào một phương trình hóa học như sau:
2Al+2NaOH+6H2O→2Na[Al(OH)4](dd)+3H2↑
IV- ỨNG DỤNG VÀ SẢN XUẤT
1. Ứng dụng
Nhôm và hợp kim nhôm có đặc tính nhẹ, bền đối với không khí và nước, được dùng làm vật liệu chế tạo máy bay, ôtô, tên lửa, tàu vũ trụ.
Nhôm và hợp kim nhôm có màu trắng bạc, đẹp, được dùng làm khung cửa và vật trang trí nội thất.
Nhôm có tính dẫn điện, dẫn nhiệt tốt, được dùng làm dây cáp dẫn điện thay thế cho đồng là kim loại đắt tiền. Nhôm được dùng chế tạo các thiết bị trao đổi nhiệt, các dụng cụ đun nấu trong gia đình.
Bột nhôm dùng để chế tạo hỗn hợp tecmit (hỗn hợp bột Al và Fe2O3), được dùng để hàn gắn đường ray,...
2. Sản xuất
Trong công nghiệp, nhôm được sản xuất từ quặng boxit bằng phương pháp điện phân. Hai công đoạn chính của quá trình sản xuất là:
Công đoạn tinh chế quặng boxit: Ngoài thành phần chính là Al2O3.2H2O trong quặng boxit còn có tạp chất là SiO2 và Fe2O3. Bằng phương pháp hóa học người ta loại bỏ các tạp chất để có Al2O3 nguyên chất.
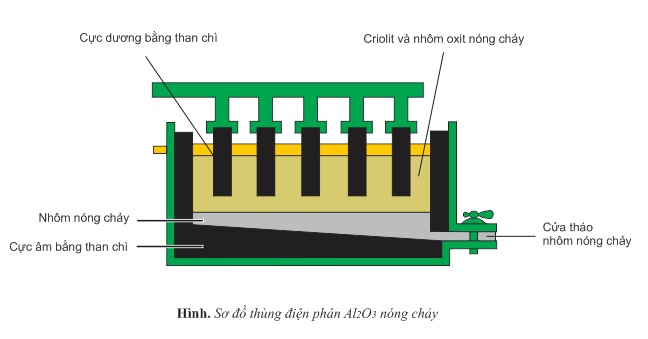
Công đoạn điện phân Al2O3 nóng chảy: Al2O3 nóng chảy ở 2050oC. Người ta trộn nó với criolit (Na3AlF6). Hỗn hợp này nóng chảy ở khoảng 900oC. Việc làm này một mặt tiết kiệm năng lượng đồng thời tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3 nóng chảy, mặt khác hỗn hợp chất điện li này có khối lượng riêng nhỏ hơn nhôm, nổi lên trên và ngăn cản Al nóng chảy không bị oxi hóa trong không khí.
Thùng điện phân có cực âm (catot) là tấm than chì ở đáy thùng. Cực dương (anot) là những khối than chì có thể chuyển động theo phương thẳng đứng.
Ở cực âm xảy ra sự khử ion Al3+ thành kim loại Al:
Al3++3e→Al
Ở cực dương xảy ra sự oxi hóa O2− thành khí O2:
2O2−→O2+4e
Phương trình điện phân Al2O3 nóng chảy:
2Al2O3→đpnc 4Al+3O2↑
Khí oxi sinh ra ở cực dương đốt cháy dần dần than chì sinh ra CO2. Do vậy trong quá trình điện phân phải hạ thấp dần các cực dương vào thùng điện phân. Để có được 1kg nhôm cần khoảng: 2kgAl2O3;0,5kgC tiêu hao ở cực dương, 8−10kWh điện năng.

.jpg)
.jpg)




.jpg)
.jpg)




















