A. KIẾN THỨC CẦN NẮM VỮNG
1. Cấu tạo bảng tuần hoàn
a) Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp e trong nguyên tử được xếp thành 1 hàng (chu kì).
- Các ngưyên tố có số e hoá trị trong nguyên tử như nhau được xếp thành 1 cột (Nhóm).
b) Ô nguyên tố: Mỗi nguyên tố được xếp vào 1 ô.
c) Chu kì
Mỗi hàng là 1 chu kì
Có 3 chu kì nhỏ : 1,2,3
Có 4 chu kì lớn: 4,5,6,7
⇒ Nguyên tử các nguyên tố thuộc 1 chu kì có số lớp e như nhau
d) Nhóm
Nhóm A: Gồm chu kì nhỏ và chu kì lớn ,từ I → VIII
Nguyên tố s thuộc nhóm I, II .
Nguyên tố p thuộc nhóm III và VIII .
Nhóm B: (III → VIII ;I II )
Nguyên tố d,f thuộc chu kì lớn
2. Sự biến đổi tuần hoàn
a) Cấu hình electron nguyên tử
Số e ngoài cùng của nguyên tử các nguyên tố ở mỗi chu kì tăng từ 1 → 8 thuộc các nhóm từ I → VIII . Cấu
hình e của nguyên tử các nguyên tố biến đổi tuần hoàn
b) Sự biến đổi tuần hoàn tính kim loại, phi kim, bán kính nguyên tử và giá trị độ âm điện của các nguyên tố được tóm tắt trong bảng sau:
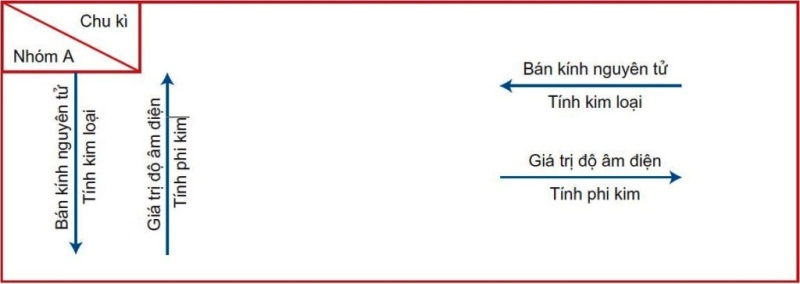
3. Định luật tuần hoàn
- Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tử đó biến đổi tuần hoàn theo chiều tăng dần của Điện tích hạt nhân nguyên tử.

.jpg)
.jpg)




.jpg)
.jpg)




















