I. AXIT SUNFURIC
1. Tính chất vật lý
Axit sunfuric (H2SO4) là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84 g/cm3).
H2SO4 tan vô hạn trong nước và toả nhiệt rất nhiều nhiệt. Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy, muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thuỷ tinh mà không được làm ngược lại.
2. Tính chất hoá học
a. Tính chất của dung dịch axit sunfuric loãng
Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại hoạt động, giải phóng khí hiđro.
- Tác dụng với oxit bazơ và với bazơ.
- Tác dụng được với nhiều muối.
b. Tính chất của axit sunfuric đặc
Axit sunfuric đặc có những tính chất hoá học đặc trưng sau:
- Tính oxi hoá mạnh:
Axit sunfuric đặc, nóng có tính oxi hoá rất mạnh, nó oxi hoá được hầu hết các kim loại (trừ Au, Pt), nhiều phi kim (C, S, P,...) và nhiều hợp chất:
2H2SO4 + Cu ––> CuSO4 + H2O + SO2
2H2SO4 + S ––> 3SO2 + 2H2O
2H2SO4 + 2KBr ––> Br2 + SO2 + 2H2O + K2SO2
- Tính háo nước.
Axit sunfuric đặc hấp thụ mạnh nước. Nó cũng hấp thụ nước từ các hợp chất từ các hợp chất gluxit. Thí dụ, nhỏ H2SO4 đặc vào đường saccarozơ
3. Ứng dụng
Axit sunfuric là hoá chất hàng đầu được dùng trong nhiều ngành sản xuất. Hàng năm, các nước trên thế giới sản xuất khoảng 160 triệu tấn H2SO4.
Axit sunfuric được dùng để sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ...
4. Sản xuất axit sunfuric
Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. Phương pháp này có 3 công đoạn chính.
a. Sản xuất lưu huỳnh đioxit (SO2)
Phụ thuộc vào nguồn nguyên liệu có sẵn, người ta đi từ nguyên liệu ban đầu là lưu huỳnh hoặc pirit sắt FeS2...
- Đốt cháy lưu huỳnh:
S + O2 ––> SO2
- Đốt quặng pirit sắt FeS2:
4FeS2 + 11O2 ––>2Fe2O3 + 8SO2
b. Sản xuất lưu huỳnh trioxit (SO3)
Oxi hoá SO2 bằng khí oxi hoặc không khí dư ở nhiệt độ 450 - 500oC, chất xúc tác là vanađi(V) oxit V2O5:
2SO2 + O2 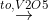 2SO3
2SO3
c. Hấp thụ SO3 bằng H2SO4
Dùng H2SO4 98% hấp thụ SO3, được oleum H2SO4 .nSO3:
H2SO4 + nSO3 ––>H2SO4 .nSO3
Sau đó dùng lượng nước thích hợp pha loãng oleum, được H2SO4 đặc:
H2SO4 .nSO3 + nH2O ––> (n + 1) H2SO4
II. MUỐI SUNFAT. NHẬN BIẾT ION SUNFAT
1. Muối sunfat
Muối sunfat là muối của axir sunfuric. Có 2 loại muối sunfat:
- Muối trung hoà (muối sunfat) chứa ion sunfat SO. Phần lớn muối sunfat đều tan trừ BaSO4, SrSO4, PbSO4 không tan.
- Muối axit (muối hiđrosunfat) chứa ion hiđrosunfat HSO
2. Nhận biết ion sunfat
Thuốc thử nhận biết ion sunfat SOlà dung dịch muối bari. Sản phẩm phản ứng là bari sunfat BaSO4 kết tủa trắng, không tan trong axit.
nhận biết muối sunfat
H2SO4 + BaCl2 ––> BaSO4 + 2HCl
Na2SO4 + Ba(OH)2 ––> BaSO4 + 2NaOH

.jpg)
.jpg)




.jpg)
.jpg)




















