A. CACBON MONOXIT
I. TÍNH CHẤT VẬT LÝ
- Là chất khí không màu, không mùi, không vị
- Hơi nhẹ hơn không khí, ít tan trong nước
- Hóa lỏng ở -191,5oC, hóa rắn ở -205,2oC, rất bền với nhiệt
- CO là khí rất độc
II. TÍNH CHẤT HÓA HỌC
1. Cacbon monooxit là oxit không tạo muối ( oxit trung tính)
Ở điều kiện thường không tác dụng với H2O, axít, kiềm.
2. Tính khử
CO cháy trong oxi hoặc không khí: 2CO + O2 ![]() 2CO2
2CO2
Tác dụng với nhiều oxít kim loại (đứng sau Al)
3CO + Fe2O3 ![]() 3CO2 + 2Fe
3CO2 + 2Fe
III. ĐIỀU CHẾ
Trong phòng thí nghiệm
HCOOH 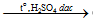 CO + H2O
CO + H2O
Trong công nghiệp
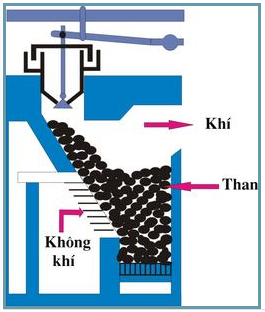
Sơ đồ lò gas
C + H2O ![]() CO + H2 (khí than ướt)
CO + H2 (khí than ướt)
CO2 + C ![]() 2CO (khí than khô)
2CO (khí than khô)
B. CACBON ĐIOXIT
I. TÍNH CHẤT VẬT LÝ
- Chất khí, không màu, nặng gấp 1,5 lần không khí
- Tan không nhiều trong nước
- Ở trạng thái rắn, CO2 tạo thành một khối trắng gọi là "nước đá khô". Nước đá khô không nóng chảy mà thăng hoa, dùng để tạo môi trường lạnh, không có hơi ẩm.
II. TÍNH CHẤT HÓA HỌC
- CO2 là khí không duy trì sự sống và sự cháy.
- CO2 là oxít axít
- Tan trong nước tạo H2CO3.
CO2(k) + H2O(l) ⇆ H2CO3 (dd).
III. ĐIỀU CHẾ
1. Trong Phòng thí nghiệm
CaCO3 +2HCl→ CaCl2+CO2+ H2O.
2. Trong Công nghiệp
CaCO3 ![]() CaO + CO2
CaO + CO2
C. AXIT CACBONIC VÀ MUỐI CACBONAT
I. AXIT CACBONIC
H2CO3 là axít 2 nấc rất yếu, kém bền phân huỷ thành CO2 và H2O.
H2CO3 ⇆ H+ + HCO3-
HCO3- ⇆ H+ + CO3 2-
II. MUỐI CACBONAT
1. Tính chất
a) Tính tan
Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat đều tan trong nước
Muối cacbonat của kim loại khác không tan trong nước
b) Tác dụng với axít
NaHCO3 + HCl → NaCl + CO2 + H2O
HCO3- + H+ →CO2 + H2O
Na2CO3 + 2HCl → 2NaCl+CO2 + H2O
CO32- + 2H+ → CO2 + H2O
c) Tác dụng với dung dịch kiềm
Muối hidrocacbonat tác dụng dễ dàng với dung dịch kiềm.
NaHCO3 + NaOH → Na2CO3 + H2O
HCO3- + OH- → CO32- + H2O
d) Phản ứng nhiệt phân
Muối cacbonat trung hòa của kim loại kiềm bền với nhiệt. Muối cacbonat trung hòa với kim loại khác, cũng như muối hidrocacbonat, bị nhiệt phân hủy
MgCO3(r) ![]() MgO(r) + CO2(k)
MgO(r) + CO2(k)
2NaHCO3(r) ![]() Na2CO3(r) + CO2 + H2O
Na2CO3(r) + CO2 + H2O
2. Ứng dụng
CaCO3 là chất bột màu trắng, nhẹ, được dùng làm chất độn trong một số ngành công nghiệp.
Na2CO3: Dùng trong công nghiệp thuỷ tinh, đồ gốm, bột giặt
NaHCO3: Dùng trong công nghiệp thực phẩm, dược phẩm

.jpg)
.jpg)




.jpg)
.jpg)




















