I. CACBON OXIT
- Công thức phân tử CO; phân tử khối bằng 28.
1. Tính chất vật lí
- CO là chất khí không màu, không mùi, ít tan trong nước, hơi nhẹ hơn không khí.
- Khí CO rất độc đối với con người, do có thể kết hợp với hemoglobin trong hồng cầu, từ đó làm mất chức năng vận chuyển khí oxi của hồng cầu. Oxi không được cung cấp đầy đủ cho các tế bào có thể dẫn đến tử vong.
2. Tính chất hóa học
a) CO là oxit trung tính
- Ở điều kiện thường CO không phản ứng với nước, axit, bazơ.
b) CO là chất khử
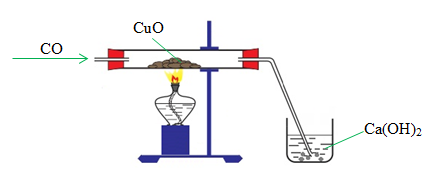
- Ở nhiệt độ cao, CO khử được nhiều oxit kim loại như Fe2O3, Fe3O4, FeO, CuO, PbO,…
CO(k) + CuO(r) -> Cu(r) + CO2(k) (điều kiện nhiệt độ)
- CO khử oxit sắt trong lò cao.
4CO + Fe3O4 -> 4CO2 + 3Fe (điều kiện nhiệt độ)
- CO tác dụng với khí O2 tạo thành CO2.
2CO(k)+ O2(k) -> 2CO2(k) (điều kiện nhiệt độ)
3. Ứng dụng
- Khí CO có nhiều ứng dụng trong công nghiệp, CO được dùng làm nhiên liệu, chất khử, ... Ngoài ra CO còn được dùng làm nguyên liệu trong công nghiệp hóa học.
II. CACBON ĐIOXIT
- Công thức phân tử CO2, phân tử khối 44.
1. Tính chất vật lí
- CO2 là khí không màu, không mùi, nặng hơn không khí.
- Khí CO2 không duy trì sự sống và sự cháy.
- Khí CO2 bị nén và làm lạnh thì hóa rắn, được gọi là nước đá khô. Người ta dùng nước đá khô để bảo quản thực phẩm.
2. Tính chất hóa học
a) Tác dụng với nước
CO2(k) + H2O (dd) ⇌ H2CO3 (dd) (Phản ứng thuận nghịch).
b) Tác dụng với dung dịch bazơ
CO2(k) + 2NaOH(dd) → Na2CO3(dd) + H2O
CO2(k) + NaOH(dd) → NaHCO3(dd)
- Tùy thuộc vào tỉ lệ giữa số mol CO2 và NaOH mà có thể tạo ra muối trung hòa, muối axit hay cả 2 muối.
c) Tác dụng với oxit bazo
CO2(k) + CaO(r) ->CaCO3(r) (điều kiện nhiệt độ)
3. Ứng dụng
- Người ta sử dụng CO2 để chữa cháy, bảo quản thực phẩm. Ngoài ra CO2 còn được dùng trong sản xuất nước giải khát có gaz, sản xuất sôđa, phân đạm, ...

.jpg)
.jpg)




.jpg)
.jpg)




















