I- NATRI HIĐROXIT, NaOH
1.Tính chất
Natri hiđroxit là chất rắn, không màu, hút ẩm, nóng chảy ở 322oC, tan nhiều trong nước.
Natri hiđroxit là bazơ mạnh, khi tan trong nước nó phân li hoàn toàn thành ion:
NaOH(dd) → Na+(dd)+ OH−(dd)
Tác dụng với axit, oxit axit tạo thành muối và nước.
Tác dụng với một số dung dịch muối, tạo thành bazơ không tan.
Thí dụ: Cu2+(dd)+2OH−(dd)→Cu(OH)2(r)
2. Ứng dụng
Natri hiđroxit có nhiều ứng dụng quan trọng trong các ngành công nghiệp chế biến dầu mỏ, luyện nhôm, xà phòng, giấy, dệt,...
3. Điều chế
Sản lượng NaOH hằng năm trên thế đạt khoảng 31.000.000 tấn. Trong công nghiệp, người ta điều chế NaOH bằng cách điện phân dung dịch NaCl bão hòa. Thùng điện phân dung dịch NaCl có cực âm bằng sắt, cực dương bằng than chì. Giữa hai điện cực có vách ngăn xốp.
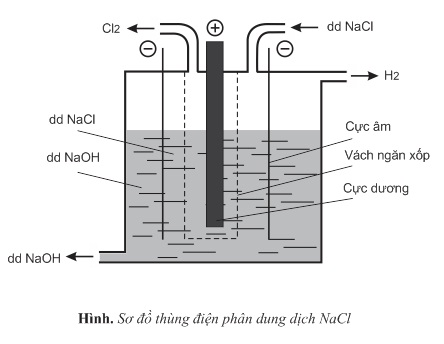
Ở điện cực âm (catot)
Trên bề mặt của cực âm có các ion Na+ và phân tử H2O. Ở đây xảy ra sự khử các phân tử H2O: 2H2O+2e→H2+2OH−
Ở cực dương (anot)
Trên bề mặt cực dương có các ion Cl− và phân tử H2O. Ở đây xảy ra sự oxi hóa các ion Cl−: 2Cl−→Cl2+2e
Phương trình điện phân dung dịch NaCl (có vách ngăn):
2NaCl+2H2O−→điện phân có vách ngăn H2↑+Cl2↑+2NaOH
Dung dịch NaOH thu được có lẫn nhiều NaCl.Người ta cô đặc dung dịch, NaCl ít tan so với NaOH nên kết tinh trước. Tách NaCl ra khỏi dung dịch, còn lại là dung dịch NaOH.
II- NATRI HIĐROCACBONAT VÀ NATRI CACBONAT
1. Natri hiđrocacbonat, NaHCO3
a) Tính chất
Bị phân hủy bởi nhiệt:
2NaHCO3→to Na2CO3+H2O+CO2↑
Tính lưỡng tính:
NaHCO3 là muối của axit yếu, tác dụng được với nhiều axit
NaHCO3+HCl→NaCl+H2O+CO2↑
Phương trình ion rút gọn:
HCO3−+H+→H2O+CO2↑
Trong phản ứng này, ion HCO−3 nhận proton, thể hiện tính chất của bazơ.
NaHCO3 là muối axit, tác dụng được với dung dịch bazơ tạo ra muối trung hòa
NaHCO3+NaOH→Na2CO3+H2O
Phương trình ion rút gọn:
HCO−3+OH−→CO2−3+H2O
Trong phương trình phản ứng này, ion HCO−3 nhường proton, thể hiện tính chất của axit.
Nhận xét: Muối NaHCO3 có lưỡng tính, là tính chất của ion HCO−3: Khi tác dụng với axit, nó thể hiện tính bazơ; khi tác dụng với bazơ, nó thể hiện tính axit. Tuy nhiên, tính bazơ chiểm ưu thế.
b) Ứng dụng
Natri hiđrocacbonat được dùng trong y học, công nghệ thực phẩm, chế tạo nước giải khát,...
2. Natri cacbonat, Na2CO3
a) Tính chất
Natri cacbonat dễ tan trong nước, nóng chảy ở 850oC
Na2O3 là muối của axit yếu, tác dụng được nhiều với axit:
Na2CO3+2HCl→2NaCl+H2O+CO2↑
Phương trình ion rút gọn:
CO2−3+2H+→H2O+CO2↑
Ion CO2−3 nhận proton, có tính chất của một bazơ. Muối Na2CO3 có tính bazơ.
b) Ứng dụng
Muối natri cacbonat là nguyên liệu trong công nghiệp sản xuất thủy tinh, xà phòng, giấy, dệt và điều chế nhiều muối khác. Dung dịch natri cacbonat dùng để tẩy sạch vết dầu mỡ bám trên chi tiết máy trước khi sơn, tráng kim loại. Natri cacbonat còn được dùng trong công nghiệp sản xuất chất tẩy rửa.

.jpg)
.jpg)




.jpg)
.jpg)




















