Sắt tinh khiết ít được sử dụng trong thực tế, nhưng các hợp kim của sắt là gang và thép lại được sử dụng rất phổ biến trong các ngành công nghiệp và đời sống.
I- GANG
Gang là hợp kim của Fe với C trong đó có từ 2−5% khối lượng C, ngoài ra còn một lượng nhỏ các nguyên tố Si,Mn,S,...
1. Phân loại, tính chất và ứng dụng của gang
a) Gang trắng
Gang trắng chứa ít cacbon, rất ít silic, chứa nhiều xementit Fe3C. Gang trắng rất cứng và giòn, được dùng để luyện thép.
b) Gang xám
Gang xám chứa nhiều cacbon và silic. Gang xám kém cứng và kém giòn hơn gang trắng, khi nóng chảy thành chất lỏng linh động (ít nhớt) và khi hóa rắn thì tăng thể tích, vì vậy gang xám được dùng để đúc các bộ phận của máy, ống dẫn nước, cánh cửa,...
2. Sản xuất gang
a) Nguyên liệu
Quặng sắt dùng để sản xuất gang có chứa 30−95% oxit sắt, không chứa hoặc chứa ít lưu huỳnh, photpho.
Than cốc (không có sẵn trong tự nhiên, pải điều chế từ than mỡ) có vai trò cung cấp nhiệt khí cháy, tạo ra chất khử là CO và tạo thành gang.
Chất chảy CaCO3 ở nhiệt độ cao bị phân hủy thành CaO, sau đó hóa hợp với SiO2 là chất lỏng nóng chảy có trong quặng sắt thành xỉ silicat dễ nóng chảy,có khối lượng riêng nhỏ (D=2,5g/cm3) nổi lên trên gang (D=6,9g/cm3).
b) Những phản ứng hóa học xảy ra trong quá trình luyện quặng thành gang
- Phản ứng tạo thành chất khử CO
Không khí nóng được nén vào lò cao ở phần trên của nồi lò, đốt cháy hoàn toàn than cốc: C+O2→CO2
Nhiệt lượng của phản ứng tỏa ra làm cho nhiệt độ tới trên 1800oC. Khí CO2 đi lên phía trên gặp lớp than cốc, bị khử thành CO: CO2+C→2CO
Phản ứng này thu nhiệt làm cho nhiệt độ phần trên của phễu lò vào khoảng 1300oC
- Phản ứng khử oxi sắt
Các phản ứng CO khử các oxit sắt đều được thực hiện trong phần thân lò, có nhiệt độ từ 400−800oC:
Ở phần trên của thân lò (nhiệt độ khoảng 400oC) xảy ra phản ứng:
3Fe2O3+CO→2Fe3O4+CO2↑
Ở phần giữa của thân lò (nhiệt độ khoảng 500−600oC) xảy ra sự khử oxit sắt từ Fe3O4 thành sắt (II) oxit:
Fe3O4+CO→3FeO+CO2↑
Ở phần dưới của thân lò (nhiệt độ khoảng 700−800oC) xảy ra phản ứng khử sắt (II) oxit thành Fe:
FeO+CO→Fe+CO2↑
- Phản ứng tạo xỉ
Ở phần bụng lò (nhiệt độ khoảng 1000oC) xảy ra phản ứng phân hủy CaCO3 và phản ứng tạo xỉ:
CaCO3→CaO+CO2↑
CaO+SiO2→CaSiO3(canxisilicat)
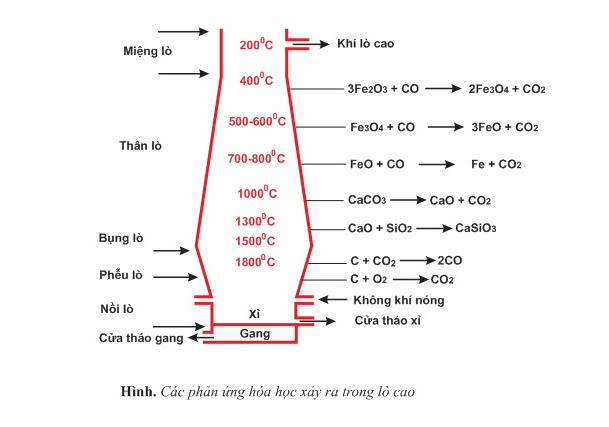
c) Sự tạo thành gang
Ở phần bụng lò (nhiệt độ khoảng 15000C) sắt nóng chảy có hòa tan một phần cacbon và một lượng nhỏ mangan, silic,... đó là gang. Gang nóng chảy tích tụ ở nồi lò. Sau một thời gian nhất định, người ta tháo gang và xỉ ra khỏi lò cao.
II- THÉP
Thép là hợp kim của Fe với C, trong đó có từ 0,01−2% khối lượng của C, ngoài ra còn có một số nguyên tố khác (Si,Mn,Cr,Ni,...)
1. Phân loại, tính chất và ứng dụng của thép
Dựa vào thành phần và tính chất, có thể phân thép thành hai nhóm:
a) Thép thường (hay thép cacbon): chứa ít cacbon, silic, mangan và rất ít lưu huỳnh, photpho. Độ cứng của thép phụ thuộc vào hàm lượng cacbon. Thép cứng chứa trên 0,9%C, thép mềm không quá 0,1%C. Loại thép này thường được sử dụng trong xây dựng nhà cửa, chế tạo các vật dụng trong đời sống.
b) Thép đặc biệt: là thép có chứa thêm các nguyên tố khác như: Si,Mn,Cr,Ni,W,V,... Thép đặc biệt có những tính chất cơ học, vật lí rất quý.
Thí dụ:
Thép Cr−Ni rất cứng dùng để chế tạo vòng bi, vỏ xe bọc thép,... Thép không gỉ có thành phần 74%Fe,18%Cr,8%Ni dùng để chế tạo dụng cụ y tế, dụng cụ nhà bếp,...
Thép W−Mo−Cr rất cứng dù ở nhiệt độ rất cao, dùng để chế tạo lưỡi dao cắt gọt kim loại cho máy tiện, máy phay,...
Thép silic có tính đàn hồi tốt, dùng để chế tạo lò xo, nhíp ôtô,...
Thép mangan rất bền, chịu được va đập mạnh, dùng để chế tạo đường ray xe lửa, máy nghiền đá,...
2. Sản xuất thép
a) Nguyên liệu
Nguyên liệu sản xuất thép gồm: gang trắng hoặc gang xám, sắt thép phế liệu; chất chảy là canxi oxit; nhiên liệu là dầu ma zút hoặc khí đốt; khí oxi.
b) Những phản ứng hóa học xảy ra trong quá trình luyện gang thành thép
Khí oxi được dùng làm chất oxi hóa các nguyên tố phi kim trong gang thành những oxit. Cacbon và lưu huỳnh bị oxi hóa thành những hợp chất khí là CO2 và SO2 tách ra khỏi gang:
C+O2→CO2
S+O2→SO2
Silic và photpho bị oxi hóa thành những oxit khó bay hơi là SiO2 và P2O5:
Si+O2→SiO2
4P+5O2→2P2O5
Những oxit này hóa hợp với chất chảy là CaO tạo thành xỉ (canxi photphat và canxi silicat) nổi lên trên bề mặt thép lỏng:
3CaO+P2O5→Ca3(PO4)2
CaO+SiO2→CaSiO3
c) Các phương pháp luyện thép
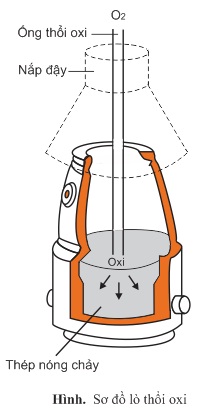
- Phương pháp Bet-xơ-me (thổi lò oxi)
Oxi nén dưới áp suất 10atm được thổi trên bề mặt và trong lòng gang nóng chảy, do vậy oxi đã oxi hóa rất mạnh những tạp chất trong gang và thành phần các chất trong thép được trộn đều.
Lò thổi oxi có ưu điểm là các phản ứng xảy ra bên trong khối gang tỏa rất nhiều nhiệt, thời gian luyện thép ngắn. Lò cỡ lớn có thể luyện được 300 tấn thép trong thời gian 45 phút. Ngày nay có khoảng 80% thép được sản xuất bằng phương pháp này.
- Phương pháp Mac-tanh (lò bằng)
Nhiên liệu là khí đốt hoặc dầu cùng với không khí và oxi được phun vào lò để oxi hóa các tạp chất trong gang.
Ưu điểm của phương pháp này là có thể kiểm soát được tỉ lệ các nguyên tố trong thép và bổ sung các nguyên tố cần thiết khác như Mn,Ni,Cr,Mo,W,V,... Do vậy, có thể luyện được những loại thép có chất lượng cao.
Mỗi mẻ thép ra lò có khối lượng chừng 300 tấn trong thời gian từ 5−8 giờ. Khoảng 12−15% thép trên thế giới được sản xuất theo phương pháp này.
- Phương pháp lò điện
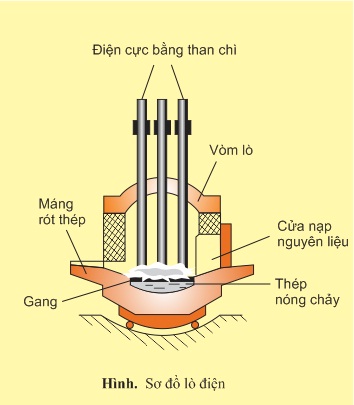
Trong lò điện, các thanh than chì là một điện cực, gang được dùng như là điện cực thứ hai. Hồ quang sinh ra giữa chúng tạo được nhiệt độ cao hơn và dễ điều chỉnh hơn so với các loại lò trên. Do vậy phương pháp lò hồ quang điện có ưu điểm là luyện được những loại thép đặc biệt mà thành phần có những kim loại khó nóng chảy như vonfam (tnc3350oC) molipđen (tnc2620oC), crom (tnc1890oC) và loại được hầu hết những nguyên tố có hại cho thép như lưu huỳnh , photpho. Nhược điểm của lò hồ quang điện là dung tích nhỏ nên khối lượng mỗi mẻ thép ra lò không lớn.

.jpg)
.jpg)




.jpg)
.jpg)




















