I - PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HÓA HỌC
1. Phản ứng một chiều
Xét phản ứng: 2KClO3→(toMnO2) 2KCl+3O2
Khi đun nóng các tinh thể KClO3 có mặt chất xúc tác MnO2,KClO3 phân hủy thành KCl và O2. Cũng trong điều kiện đó, KCl và O2 không phản ứng được với nhau tạo lại KClO3, nghĩa là phản ứng chỉ xảy ra theo một chiều từ trái sang phải. Phản ứng như thế được gọi là phản ứng một chiều. Trong phương trình hóa học của phản ứng một chiều, người ta dùng một mũi tên chỉ chiều phản ứng.
2. Phản ứng thuận nghịch
Xét phản ứng: Cl2+H2O ⇌ HCl+HClO
Ở điều kiện thường, Cl2 phản ứng với H2O tạo thành HCl và HClO, đồng thời HCl và HClO sinh ra cũng tác dụng được với nhau tạo lại Cl2 và H2O, nghĩa là trong cùng điều kiện phản ứng xảy ra theo hai chiều trái ngược nhau. Phản ứng như thế được gọi là phản ứng thuận nghịch.
Trong phương trình hóa học của phản ứng thuận nghịch, người ta dùng hai mũi tên ngược chiều nhau thay cho một mũi tên đối với phản ứng một chiều. Chiều mũi tên từ trái sang phải là chiều phản ứng thuận, chiều mũi tên từ phải sang trái là chiều phản ứng nghịch.
3. Cân bằng hóa học
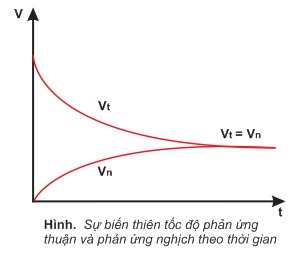
Xét phản ứng thuận nghịch sau:
H2(k)+I2(k)⇌2HI(k)
Cho H2 và I2 vào trong một bình kín ở nhiệt độ cao và không đổi. Lúc đầu tốc độ phản ứng thuận (vt) lớn vì nồng độ H2 và I2 lớn, trong khi đó tốc độ phản ứng nghịch (vn) bằng không, vì nồng độ HI bằng không. Trong quá trình diễn ra phản ứng nồng độ H2 và I2 giảm dần nên vt giảm dần, còn vn tăng dần, vì nồng độ HI tăng dần. Đến một lúc nào đó vt bằng vn, khi đó nồng độ các chất trong phản ứng thuận nghịch trên đây được giữ nguyên, nếu nhiệt độ không biến đổi. Trạng thái này của phản ứng thuận nghịch được gọi là cân bằng hóa học.
Ở trạng thái cân bằng, phản ứng không dừng lại, mà phản ứng thuận và phản ứng nghịch vẫn xảy ra, nhưng với tốc độ bằng nhau (vt=vn). Điều này có nghĩa là trong cùng một đơn vị thời gian, nồng độ các chất phản ứng giảm đi bao nhiêu theo phản ứng thuận lại được tạo ra bấy nhiêu theo phản ứng nghịch. Do đó, cân bằng hóa học là cân bằng động.
Kết luận: Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Đặc điểm của phản ứng thuận nghịch là các chất phản ứng không chuyển hóa hoàn toàn thành các sản phẩm, nên trong hệ cân bằng có mặt các chất phản ứng và các sản phẩm.
Thí dụ, cho 0,500mol/l H2 và 0,500mol/l I2 vào trong một bình kín ở nhiệt độ 430oC. Nếu phản ứng là một chiều thì H2 và I2 sẽ phản ứng hết tạo thành 1,000mol/l HI. Nhưng đây là phản ứng thuận nghịch, nên chỉ thu được 0,786mol/l HI và còn lại 0,107mol/l H2,0,107mol/l H2.
Tình hình tương tự khi đun nóng 1,000mol/lHI trong bình kín ở 430oC. Kết quả cũng chỉ tạo thành 0,107mol/l H2 và còn lại 0,786mol/l HI.
II - HẰNG SỐ CÂN BẰNG
1. Cân bằng trong hệ đồng thể
Xét hệ cân bằng sau:
N2O4(k)⇌2NO2(k)(1)
Nghiên cứu thực nghiệm hệ cân bằng này ở 25oC, người ta đã thu được các số liệu trong bảng 7.2.
Bảng 7.2
Hệ cân bằng N2O4(k)⇌ 2NO2(k) ở 25oC
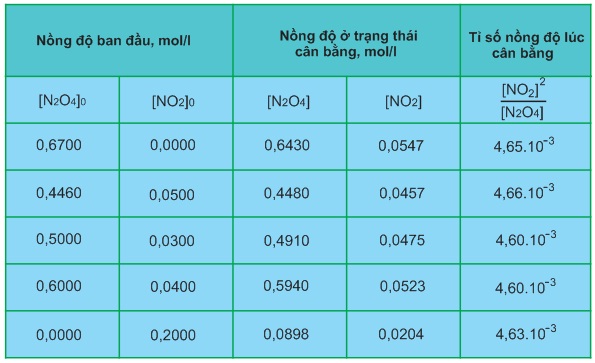
Từ các số liệu trong bảng 7.2 ta thấy tỉ số nồng độ lúc cân bằng: [NO2]2 / [N2O4] hầu như không đổi với giá trị trung bình là 4,63.10−3, dù cho nồng độ ban đầu của N2O4 và NO2 biến đổi. Giá trị không đổi này được xác định ở 25oC và nồng độ các chất lúc cân bằng, nên được gọi là hằng số cân bằng của phản ứng ở 25oC. Hằng số cân bằng được kí hiệu bằng chữ K. Đối với phản ứng (1) ta có biểu thức của hằng số cân bằng như sau:
Kc=[NO2]2 / [N2O4]=4,63.10−3 ở 25oC
Trong đó: [NO2] và [N2O4] là nồng độ mol/l của NO2 và N2O4 ở trạng thái cân bằng. Số mũ 2 ở nồng độ NO2 và số mũ 1 ở nồng độ N2O4 ứng đúng với hệ số tỉ lượng của chúng trong phương trình hóa học của phản ứng (1).
Hằng số cân bằng Kc của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
Một cách tổng quát, nếu có phản ứng thuận nghịch sau:
aA+bB⇌cC+dD
A,B,C và D là những chất khí hoặc những chất tan trong dung dịch.
Khi phản ứng ở trạng thái cân bằng, ta có:
Kc=[C]c[D]d / [A]a[B]b
Trong đó: [A],[B],[C] và [D] là nồng độ mol/l của các chất A,B,C và D ở trạng thái cân bằng: a,b,c và d là hệ số tỉ lượng các chất trong phương trình hóa học của phản ứng. Nồng độ các sản phẩm (ở vế phải phương trình hóa học) được đặt ở tử số, còn nồng độ các chất phản ứng (ở vế trái phương trình hóa học) được đặt ở mẫu số.
2. Cân bằng trong hệ dị thể
Xét hệ cân bằng sau: C(r)+CO2(k) ⇌ 2CO(k)
Nồng độ của chất rắn được coi là hằng số, nên nó không có mặt trong biểu thức hằng số cân bằng Kc. Đối với cân bằng trên ta có:
Kc=[CO]2 / [CO2]
Giá trị hằng số cân bằng có ý nghĩa rất lớn, vì nó cho biết lượng các chất phản ứng còn lại và lượng các sản phẩm được tạo thành ở vị trí cân bằng, do đó biết được hiệu suất của phản ứng. Thí dụ:
CaCO3(r)⇌CaO(r)+CO2(k);Kc=[CO2]
Ở 820oC,Kc=4,28.10−3, do đó [CO2]=4,28.10−3mol/l;
Ở 880oC,Kc=1,06.10−2, nên [CO2]=1,06.10−2mol/l.
Vậy ở nhiệt độ cao hơn, khi phản ứng ở trạng thái cân bằng, lượng CO2 (đồng thời lượng CaO) tạo thành theo phản ứng nhiều hơn nghĩa là ở nhiệt độ cao hơn hiệu suất chuyển hóa CaCO3 thành CaO và CO2 lớn hơn.
III - SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
1. Thí nghiệm
Lắp một dụng cụ gồm hai ống nghiệm có nhánh (a) và (b), được nối với nhau bằng ống nhựa mềm, có khóa K mở.
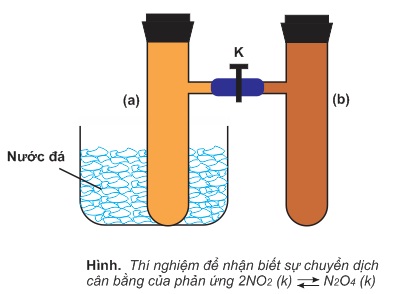
Nạp đầy khí NO2 vào cả hai ống (a) và (b) ở nhiệt độ thường. Nút kín cả hai ống, trong đó có cân bằng sau:
2NO2(k)⇌N2O4(k)
(màu nâu đỏ) (không màu)
Màu của hỗn hợp khí trong cân bằng ở cả hai ống (a) và (b) là như nhau.
Đóng khóa K lại ngăn không cho khí ở hai khuyếch tán vào nhau. Ngâm ống (a) vào nước đá. Một lát sau lấy ra so sánh màu ở ống (a) với ống (b), ta thấy màu ở ống (a) nhạt hơn. Như vậy, khi ta làm lạnh ống (a), các phân tử NO2 trong ống đó đã phản ứng thêm để tạo ra N2O4, làm nồng độ NO2 giảm bớt và nồng độ N2O4 tăng thêm. Hiện tượng đó được gọi là sự chuyển dịch cân bằng hóa học.
2. Định nghĩa
Sự chuyển dịch cân bằng hóa học là sự di chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
Những yếu tố làm chuyển dịch cân bằng là nồng độ, áp suất và nhiệt độ. Chúng được gọi là các yếu tố ảnh hưởng đến cân bằng hóa học.
IV - CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
1. Ảnh hưởng của nồng độ
Xét hệ cân bằng sau trong một bình kín ở nhiệt độ cao và không đổi:
C(r)+CO2(2)⇌2CO(k)(2)
Kc=[CO]2 / [CO2]
Ở 800oC, hắng số cân bằng Kc không biến đổi và bằng 9,2.10−2.
Nếu ta cho thêm khí CO2 vào hệ cân bằng thì nồng độ CO2 tăng lên làm cho giá trị Kc sẽ nhỏ hơn 9,2.10−2. Để cho giá trị Kc không biến đổi, lượng CO2 được thêm vào phải giảm bớt và lượng CO phải tăng thêm, nghĩa là CO2 phải phản ứng thêm với C tạo ra CO cho tới khi đạt được cân bằng mới, ứng với giá trị Kc bằng 9,2.10−2. Vậy khi thêm CO2 vào hệ cân bằng, cân bằng sẽ chuyển dịch từ trái sang phải (theo chiều thuận) . Hiện tượng sẽ xảy ra tương tự như trên khi ta lấy bớt khí CO2 ra khỏi hệ cân bằng.
Ngược lại, nếu ta cho thêm một lượng khí CO vào hệ cân bằng (2), hoặc lấy bớt khí CO2 ra, thì cân bằng sẽ chuyển dịch từ phải sang trái (theo chiều nghịch).
Nhận xét: Khi tăng hoặc giảm nồng độ một chất trong cân bằng, thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác dụng của việc tăng hoặc giảm nồng độ của chất đó.
Lưu ý rằng, nếu trong hệ cân bằng có chất rắn (ở dạng nguyên chất) thì việc thêm hoặc bớt lượng chất rắn không ảnh hưởng đến cân bằng, nghĩa là cân bằng không chuyển dịch. Thí dụ, nếu cho thêm hoặc lấy bớt lượng cacbon trong hệ cân bằng (2) thì cân bằng sẽ không bị ảnh hưởng, vì hằng số cân bằng Kc không phụ thuộc vào lượng cacbon.
2. Ảnh hưởng của áp suất
Xét lại hệ cân bằng (1) trong xi lanh kín có pít tông ở nhiệt độ thường và không đổi:
N2O4(k)⇌2NO2(k)(1)
Kc=[NO2]2 / [N2O4]
Khi hệ đang ở trạng thái cân bằng, nếu ta tăng áp suất chung của hệ, thí dụ tăng hai lần, bằng cách đẩy pít tông vào để cho thể tích chung của hệ giảm hai lần, ngay lúc đó nồng độ của NO2 và N2O4 đều tăng hai lần. Kết quả là tử số trong biểu thức tính Kc tăng 4 lần trong khi mẫu số chỉ tăng 2 lần. Ở nhiệt độ xác định, hằng số cân bằng Kc không đổi, nên để bù lại việc tăng ít của mẫu số, số mol khí N2O4 phải được tạo thêm, đồng thời số mol khí NO2 phải giảm bớt, nghĩa là cân bằng phải chuyển dịch theo chiều nghịch.
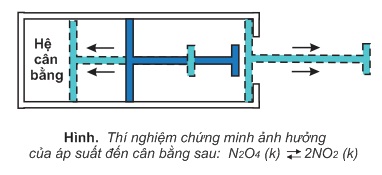
Nhận xét: Từ phản ứng (1) ta thấy, cứ hai mol khí NO2 phản ứng tạo ra một mol khí N2O4, nghĩa là phản ứng nghịch làm giảm số mol khí trong hệ, do đó làm giảm áp suất chung của hệ.
Như vậy, khi tăng áp suất chung của hệ cân bằng trên, cân bằng chuyển dịch theo chiều nghịch, chiều làm giảm áp suất chung của hệ, nghĩa là chuyển dịch về phía làm giảm tác dụng của việc tăng áp suất chung.
Bây giờ nếu ta làm giảm áp suất chung của hệ cân bằng trên bằng cách kéo pít tông ra để cho thể tích chung của hệ tăng lên, cân bằng sẽ chuyển dịch theo chiều thuận, chiều làm tăng số mol khí trong hệ, nghĩa là về phía làm giảm tác dụng của việc giảm áp suất chung.
Kết luận: Khi tăng hoặc giảm áp suất chung của hệ cân bằng thì bao giờ cân bằng cũng chuyển dịch theo chiều làm giảm tác dụng của việc tăng hoặc giảm áp suất đó.
Từ việc khảo sát ở trên ta suy ra rằng, khi hệ cân bằng có số mol khí ở hai vế của phương trình hóa học bằng nhau hoặc trong hệ không có chất khí thì việc tăng hoặc giảm áp suất chung không làm cho cân bằng chuyển dịch. Thí dụ, áp suất không ảnh hưởng đến các cân bằng sau:
H2(k)+I2(k)⇌2HI(k)
Fe2O3(r)+3CO(k)⇌2Fe(r)+3CO2(k)
CaO(r)+SiO2(r)⇌CaSiO3(r)
3. Ảnh hưởng của nhiệt độ
Hằng số cân bằng Kc của phản ứng xác định chỉ phụ thuộc vào nhiệt độ, nên khi nhiệt độ biến đổi, cân bằng sẽ chuyển dịch sang một trạng thái cân bằng mới ứng với giá trị mới của hằng số cân bằng. Thí dụ:
N2O4(k)⇌2NO2(k); ΔH=58kJ>0
(không màu) (màu nâu đỏ)
Giá trị 58kJ là nhiệt của phản ứng thuận, phản ứng thu nhiệt. Phản ứng nghịch là phản ứng tỏa nhiệt với ΔH=−58kJ<0.
Khi hỗn hợp khí trên đang ở trạng thái cân bằng, nếu đun nóng hỗn hợp khí bằng cách ngâm bình đựng hỗn hợp vào nước sôi, màu nâu đỏ của hỗn hợp khí đậm lên, nghĩa là cân bằng chuyển dịch theo chiều thuận, chiều của phản ứng thu nhiệt.
Nếu làm lạnh bằng cách ngâm bình đựng hỗn hợp khí vào nước đá, màu của hỗn hợp khí nhạt đi, nghĩa là cân bằng chuyển dịch theo chiều nghịch, chiều của phản ứng tỏa nhiệt.
Kết luận: Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác dụng của việc tăng nhiệt độ và khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt, chiều làm giảm tác dụng của việc giảm nhiệt độ.
Các yếu tố nồng độ, áp suất và nhiệt độ ảnh hưởng đến cân bằng hóa học đã được Lơ Sa-tơ-li-ê (nhà hóa học Pháp - tác giả của nguyên lí chuyển dịch cân bằng) tổng kết thành nguyên lí được gọi là nguyên lí Lơ Sa-tơ-li-ê như sau:
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
4. Vai trò của chất xúc tác
Chất xúc tác không làm biến đổi nồng độ các chất trong cân bằng và cũng không làm biến đổi hằng số cân bằng, nên không làm cân bằng chuyển dịch. Chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau, nên khi phản ứng thuận nghịch chưa ở trạng thái cân bằng thì chất xúc tác có tác dụng làm cho cân bằng được thiết lập nhanh chóng hơn.
V - Ý NGHĨA CỦA TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC TRONG SẢN XUẤT HÓA HỌC
Để thấy ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học, chúng ta lấy một số thí dụ sau:
Thí dụ 1: Trong quá trình sản xuất axit sunfuric phải thực hiện phản ứng sau:
2SO2(k)+O2(k)⇌2SO3(k); ΔH=−198kJ<0
Trong phản ứng này, người ta dùng oxi không khí.
Ở nhiệt độ thường, phản ứng xảy ra rất chậm. Để tăng tốc độ phản ứng, phải tăng nhiệt độ và dùng chất xúc tác. Nhưng đây là phản ứng tỏa nhiệt nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch làm giảm hiệu suất của phản ứng. Để hạn chế tác dụng này, người ta đã dùng một lượng dư không khí, nghĩa là tăng nồng độ oxi, làm cho cân bằng chuyển dịch theo chiều thuận.
Thí dụ 2: Trong công nghiệp, amoniac được tổng hợp theo phản ứng sau:
N2(k)+3H2(k)⇌2NH3(k);ΔH=−92kJ<0
Đặc điểm của phản ứng này là tốc độ rất chậm ở nhiệt độ thường, tỏa nhiệt và số mol khí của sản phẩm ít hơn số mol khí của các chất phản ứng. Do đó, người ta phải thực hiện phản ứng này ở nhiệt độ cao, áp suất cao và dùng chất xúc tác. Ở áp suất cao, cân bằng sẽ chuyển dịch sang phía tạo ra NH3, nhưng ở nhiệt độ cao cân bằng sẽ chuyển dịch ngược lại, nên chỉ thực hiện phản ứng ở nhiệt độ thích hợp.

.jpg)
.jpg)




.jpg)
.jpg)




















