I- PHƯƠNG PHÁP PHÂN TÍCH CHUẨN ĐỘ
Phương pháp phân tích chuẩn độ là phương pháp hóa học định lượng, dựa trên sự đo thể tích dung dịch thuốc thử có nồng độ đã biết phản ứng với một thể tích xác định dung dịch của chất có nồng độ chưa biết cần xác định. Cách xác định nồng độ của dung dịch đó gọi là sự chuẩn độ.
Trong phương pháp phân tích chuẩn độ, người ta dùng nhiều loại phản ứng hóa học như phản ứng trung hòa, phản ứng oxi hóa - khử và lấy tên của các loại phản ứng đó đặt tên cho các phương pháp, nên ta có phương pháp chuẩn độ axit - bazơ, phương pháp chuẩn độ hóa - khử.
Chú ý: Mỗi phép chuẩn độ tiến hành ba lần để lấy kết quả trung bình của ba lần đó.
1. Sự chuẩn độ. Các dụng cụ trong phương pháp chuẩn độ
Trong phân tích chuẩn độ, dung dịch thuốc thử đã biết chính xác nồng độ gọi là dung dịch chuẩn. Khi chuẩn độ người ta thêm từ từ dung dịch chuẩn đựng trong buret vào dung dịch cần xác định nồng độ đựng trong bình tam giác. Thời điểm mà chất cần xác định nồng độ vừa tác dụng hết với dung dịch chuẩn gọi là điểm tương đương. Để nhận biết điểm tương đương, người ta dùng những chất gây ra những hiện tượng mà ta dễ quan sát được bằng mắt như sự đổi màu, sự xuất hiện kết tủa có màu hoặc làm đục dung dịch xảy ra tại điểm tương đương hoặc sát điểm tương đương, những chất đó gọi là chất hiển thị. Chất chỉ thị cho phép ta ngừng thêm dung dịch chuẩn vào để kết thúc chuẩn độ. Thời điểm kết thúc chuẩn độ là điểm cuối.
Dựa vào phương trình hóa học của phản ứng chuẩn độ, thể tích, nồng độ dung dịch chuẩn đã dùng và thể tích dung dịch cần xác định nồng độ ta xác định được nồng độ mol của nó.
2. Dụng cụ trong phân tích
Buret: là một ống thủy tinh hình trụ nhỏ được khắc độ theo chiều dài, đầu dưới của nó được thắt lại và được lắp một khóa thủy tinh điều khiển cho dung dịch chuẩn chảy ra từ từ theo từng giọt nối tiếp nhau.
Pipet: Để lấy một thể tích chính xác dung dịch chất cần phân tích (chất cần chuẩn độ), người ta dùng một dụng cụ gọi là pipet. Pipet là ống thủy tinh dài, bé được chế tạo phình ra ở khoảng giữa, một đầu được kéo dài. Ống có vạch mức. Một số pipet có dạng xilanh. Thể tích chất lỏng chứa trong pipet được biểu diễn bằng ml và được ghi trên thành ngoài ở chỗ phần phình ra. Các pipet dạng xilanh được khắc độ chính xác tới 0,1ml.
II- CHUẨN ĐỘ AXIT - BAZƠ
1. Nguyên tắc chung
Chuẩn độ axit - bazơ, hay còn gọi là chuẩn độ trung hòa, là phương pháp phân tích chuẩn độ được sử dụng rất rộng rãi để xác định nồng độ các dung dịch axit hoặc các dung dịch bazơ. Trong phương pháp này người ta dùng dung dịch kiềm (NaOH hoặc KOH) đã biết chính xác nồng độ làm dung dịch chuẩn để chuẩn độ dung dịch axit hoặc dùng dung dịch axit mạnh (HCl,H2SO4,HNO3) đã biết chính xác nồng độ để chuẩn độ dung dịch bazơ. Thực chất các phản ứng chuẩn độ là phản ứng trung hòa. Thí dụ, chuẩn độ dung dịch HCl chưa biết nồng độ bằng dung dịch chuẩn NaOH:
HCl+NaOH→NaCl+H2O(1)
Chuẩn độ dung dịch CH3COOH bằng dung dịch chuẩn NaOH:
CH3COOH+NaOH→CH3COONa+H2O(2)
Chuẩn độ dung dịch NH3 bằng dung dịch chuẩn HCl:
NH3+HCl→NH4Cl(3)
Trong quá trình chuẩn độ, pH của dung dịch thay đổi liên tục. Tại điểm tương đương, tức là thời điểm mà dung dịch chuẩn vừa trung hòa hết dung dịch axit hoặc bazơ cần chuẩn độ, pH của dung dịch phụ thuộc vào bản chất của axit hoặc bazơ cần chuẩn độ và nồng độ của chúng. Với phản ứng (1),pH tại thời điểm tương đương là pH của dung dịch NaCl bằng 7,0 và không phụ thuộc vào nồng độ của NaCl.pH tại thời điểm tương đương của phản ứng (2) là pH của dung dịch CH3COONa (bazơ yếu), nên pH đó lớn hơn 7.pH tại thời điểm tương đương của phản ứng (3) là pH của dung dịch NH4Cl (là axit yếu), nên pH đó nhỏ hơn 7.
Để nhận ra điểm tương đương của phản ứng chuẩn độ, người ta dùng chất chỉ thị gọi là chất chỉ thị axit - bazơ hay chất chỉ thị pH. Đó là axit hữu cơ hoặc bazơ hữu cơ yếu mà màu sắc của dạng phân tử và của dạng ion khác nhau, nên màu của chất chỉ thị phụ thuộc vào pH của dung dịch.
Bảng sau đây ghi khoảng pH đổi màu của 3 chất chỉ thị thường được sử dụng nhiều trong chuẩn độ axit - bazơ.
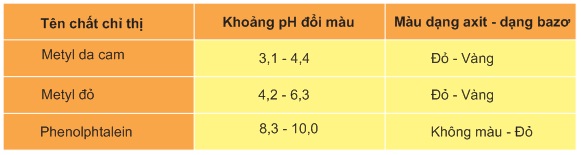
Với mỗi phản ứng chuẩn độ axit - bazơ ta chọn chất chỉ thị nào có khoảng pH đổi màu trùng hoặc rất sát với pH của điểm tương đương của sự chuẩn độ đó.
Khi chuẩn độ để tránh những sai số lớn, người ta dùng các dung dịch chuẩn có nồng độ gần với nồng độ của dung dịch chất cần xác định. Thí dụ, giả sử phải chuẩn độ 20,00ml dung dịch HCl0,100M bằng dung dịch chuẩn NaOH. Trong trường hợp này ta không nên dùng dung dịch NaOH có nồng độ lớn, thí dụ 1,00M. Trong trường hợp này điểm tương đương sẽ đạt được khi thêm vào
.png)
2. Chuẩn độ dung dịch HCl bằng dung dịch chuẩn NaOH
Trước hết ta hãy xét sự biến thiên pH trong quá trình chuẩn độ. Giả sử ta chuẩn độ V0ml dung dịch HCl nồng độ C0mol/l bằng dung dịch chuẩn NaOH nồng độ Cmol/l.
Phản ứng chuẩn độ:
HCl+NaOH→NaCl+H2O(1)
.png)
Như vậy, xung quanh điểm tương đương có một sự thay đổi pH rất đột ngột: Khi thêm 99,9mlNaOH vào tức là khi đã chuẩn độ 99,9% lượng axit thì pH của dung dịch bằng 4,3. Khi thêm vào 100,1mlNaOH tức là khi đã chuẩn độ quá 0,1% thì pH của dung dịch bằng 9,7 tức là ''bước nhảy pH là 5,4 đơn vị pH''. Nếu ta chọn các chất chỉ thị nào có khoảng đổi màu nằm trong khoảng từ 4,3 đến 9,7 để kết thúc chuẩn độ thì sao số không vượt quá 0,1%. Ta thấy trong trường hợp này có thể dùng một trong 3 chất chỉ thị metyl da cam, metyl đỏ và phenolphtalein làm chất chỉ thị.
- Cách chuẩn độ: Lấy dung dịch chuẩn NaOH vào buret. Lấy dung dịch HCl cần xác định nồng độ vào bình tam giác sạch (dùng pipet). Thêm vào đó 1−2 giọt chất chỉ thị, thí dụ phenolphtalein. Thêm từ từ dung dịch chuẩn vào đến khi dung dịch chất chỉ thị chuyển màu từ không màu sang màu hồng thì kết thúc. Đọc thể tích dung dịch chuẩn đã tiêu tốn.
- Cách tính: Nồng độ mol của dung dịch HCl được tính theo công thức
.png)

.jpg)
.jpg)




.jpg)
.jpg)




















