I- ĐỊNH NGHĨA, PHÂN LOẠI VÀ TÍNH CHẤT VẬT LÍ
1. Định nghĩa
Phenol là những hợp chất hữu cơ mà phân tử có chứa nhóm hiđroxyl (OH) liên kết trực tiếp với nguyên tử cacbon của vong benzen.
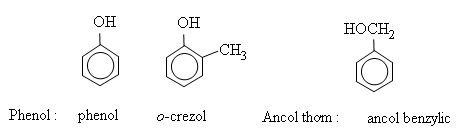
Phenol cũng là tên riêng của hợp chất cấu tạo bởi nhóm phenyl liên kết với nhóm hiđroxyl (C6H5−OH), chất tiêu biểu cho các phenol. Nếu nhóm OH đính vào mạch nhánh của vòng thơm thì hợp chất đó không thuộc loại phenol mà thuộc loại ancol thơm. Thí dụ:
2. Phân loại
* Những phenol mà phân tử có chứa 1 nhóm OH thì phenol thuộc loại monophenol
Thí dụ: phenol, o- crezol, m- crezol, p-crezol,...
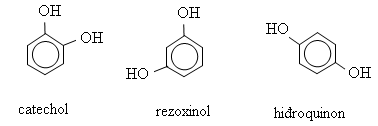
* Những phenol mà phân tử có chứa nhiều nhóm OH thì phenol thuộc loại poliphenol. Thí dụ:
3. Tính chất vật lí
Phenol, C6H5−OH, là chất rắn không màu, tan ít trong nước lạnh, tan vô hạn ở 66oC, tan tốt trong etanol, ete và axeton,... Trong quá trình bảo quản, phenol thường bị chảy rữa và thẫm màu dần do hút ẩm và bị oxi hóa bởi oxi không khí.
Phenol độc, khi tiếp xúc với da sẽ gây bỏng. Các phenol thường là chất rắn, có nhiệt độ sôi cao. Ở phenol cũng có liên kết hiđro liên phân tử tương tự như ở ancol.
II - TÍNH CHẤT HÓA HỌC
1. Tính axit
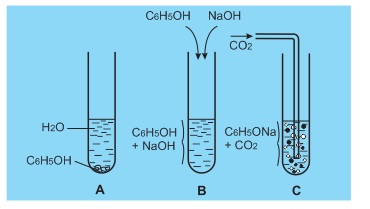
Ở ống nghiệm (A) có những hạt chất rắn do phenol tan ít trong nước. Ở ống nghiệm B phenol tan hết là do đã tác dụng với NaOH tạo thành natri phenolat tan trong nước.
C6H5OH+NaOH→C6H5ONa+H2O
Ở ống nghiệm (C), khi sục khí cacbonat vào dung dịch natri phenolat, phenol tách ra làm vẩn đục dung dịch:
C6H5−ONa+CO2+H2O→C6H5OH+NaHCO3
Phenol có lực axit mạnh hơn ancol (không những phản ứng được với kim loại kiềm mà còn phản ứng với NaOH), tuy nhiên nó vẫn chỉ là một axit rất yếu (bị axit cacbonic đẩy ra khỏi phenolat). Dung dịch phenol không làm đổi màu quỳ tím.
2. Phản ứng thế ở vòng thơm
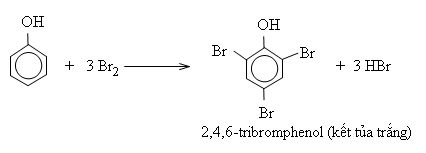
Nhỏ nước brom vào dung dịch phenol, màu nước brom bị mất và xuất hiện ngay kết tủa trắng. Phản ứng này được dùng để nhận biết phenol.
Phản ứng thế vào nhân thơm ở phenol dễ hơn ở benzen (ở điều kiện êm dịu hơn, thế được đồng thời cả 3 nguyên tử H ở các vị trí ortho và para).
3. Ảnh hưởng qua lại giữa các nhóm nguyên tử trong phân tử phenol
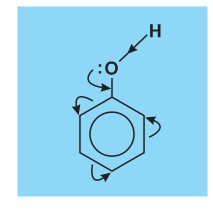
Vì sao phenol có lực axit mạnh hơn ancol? Vì sao phản ứng thế vào nhân thơm ở phenol dễ hơn ở benzen ? Đó là do ảnh hưởng qua lại giữa gốc phenyl và nhóm hiđroxyl như sau:
Cặp electron chưa tham gia liên kết của nguyên tử oxi do ở cách các electron π của vòng benzen chỉ một liên kết α làm cho mật độ electron dịch chuyển vào vòng benzen (mũi tên cong ở hình bên). Điều đó dẫn tới các hệ quả sau:
* Liên kết O−H trở nên phân cực hơn, làm cho nguyên tử H linh động hơn.
* Mật độ electron ở vòng benzen tăng lên, nhất là ở các vị trí o và p, làm cho phản ứng thế dễ dàng hơn so với benzen và đồng đẳng của nó.
* Liên kết C−O trở nên bền vững so với ở ancol, vì thế nhóm OH phenol không bị thế bởi gốc axit như nhóm OH ancol.
III - ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
Trước kia người ta sản xuất phenol từ clobenzen (xem bài Dẫn xuất halogen).
Phương pháp chủ yếu điều chế phenol trong công nghiệp hiện nay là sản xuất đồng thời phenol và axeton theo sơ đồ phản ứng sau:
.png)
Ngoài ra, phenol còn được tách từ nhựa than đá (sản phẩm phụ của quá trình luyện than cốc).
2. Ứng dụng
* Phần lớn phenol được dùng để sản xuất poliphenolfomanđehit (dùng làm chất dẻo, chất kết dính).
* Phenol được dùng để điều chế dược phẩm, phẩm nhuộm, thuốc nổ (2,4,6 - trinitrophenol), chất kích thích sinh trưởng thực vật, chất diệt cỏ 2,4−D (axit 2,4-điclophenoxiaxetic), chất diệt nấm mốc (nitrophenol), chất trừ sâu bọ,...

.jpg)
.jpg)




.jpg)
.jpg)




















