I. ĐỊNH NGHĨA
Thí dụ 1: Phản ứng đốt cháy Magie với Oxi
Phương trình hóa học: 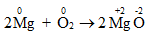
Nhận xét:
Mg có số oxi hóa là 0, O có số oxi hóa là 0.
Sau phản ứng: Mg có số oxi hóa là + 2, O có số oxi hóa là -2.
Thí dụ 2: Phản ứng giữa CuO và khí H
Phương trình hóa học: CuO + H2→ Cu + H2O
Nhận xét:
Trước phản ứng: Cu có số oxi hóa là + 2 , O có số oxi hóa là – 2 và H có số oxi hóa là 0.
Sau phản ứng: Cu có số oxi hóa là 0, O có số oxi hóa là -2 và H có số oxi hóa là + 1.
- Tổng kết:
Chất khử (chất bị oxi hóa) là chất nhường electron.
Chất oxi hóa (chất bị khử) là chất thu electron.
Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron.
Quá trình khử (sự khử) là quá trình thu electron.
Thí dụ 3: Natri cháy trong khí Clo
Phương trình hóa học: Na + Cl2 → NaCl
Nhận xét:
Trong phản ứng, nguyên tử Na nhường electron để trở thành Na
Nguyên tử Cl thu electron để trở thành Cl
Hai ion mang điện tích trái dấu này hút nhau tạo thành hợp chất ion NaCl.
Kết luận: Ở đây xảy ra đồng thời sự oxi hóa Na và sự khử Cl. Trong phản ứng này, cũng xảy ra sự nhường,
sự thu electron và có sự thay đổi số oxi hóa.
Thí dụ 4: Hidro cháy với khí Clo
Nhận xét: Ở phản ứng này, mỗi nguyên tử H và mỗi nguyên tử Cl góp một electron để hình thành cặp electron chung tạo ra hợp chất cộng hóa trị có cực HCl.
Trong phân tử HCl, cặp electron chung bị hút lệch về phía nguyên tử Cl, do nguyên tử Cl có độ âm điện lớn hơn.
Trong phản ứng có sự chuyển electron và có sự thay đổi số oxi hóa.
Kết luận:
- Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất phản ứng, hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
- Khái niệm “chất” ở đây được hiểu theo nghĩa rộng, có thể là nguyên tử, phân tử hoặc ion.
- Sự nhường electron chỉ có thể xảy ra khi có sự nhận electron. Vì vậy, sự oxi hóa và sự khử bao giờ cũng diễn ra đồng thời trong một phản ứng oxi hóa khử.
- Trong phản ứng oxi hóa khử bao giờ cũng có chất oxi hóa và chất khử tham gia.
II. LẬP PHƯƠNG TRÌNH HÓA HỌC CỦA PHẢN ỨNG OXI HÓA - KHỬ
Các bước lập phương trình hóa học.
Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử.
Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
III. Ý NGHĨA CỦA PHẢN ỨNG OXI HÓA - KHỬ TRONG THỰC TIỄN
Phản ứng oxi hóa - khử là một trong những quá trình quan trọng nhất của thiên nhiên. Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hàng loạt quá trình sinh học khác đều có cơ sở là các phản ứng oxi hóa - khử.
Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xảy ra trong pin và trong ăcquy đều bao gồm sự oxi hóa và sự khử. Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học,...đều không thực hiện được nếu thiếu các phản ứng oxi hóa - khử.
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất phản ứng; hay phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.

.jpg)
.jpg)




.jpg)
.jpg)




















