I. TÍNH KIM LOẠI, TÍNH PHI KIM
Tính kim loại :
M - ne → Mn+
- Tính Kim loại là tính chất của một nguyên tố mà nguyên tử dễ mất e để trở thành ion dương.
- Nguyên tử càng dễ nhường e tính kim loại càng mạnh
Tính phi kim:
X + ne → Xn-
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận thêm e để trở thành ion âm.
- Nguyên tử càng dễ nhận e ⇒ tính phi kim càng mạnh.
1. Sự biến đổi tính chất trong một chu kì
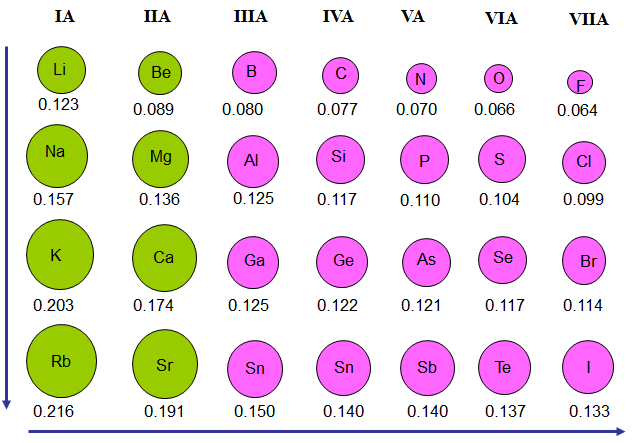
Trong một chu kì : Trong 1 chu kì khi đi từ trái sang phải : Z+ tăng dần nhưng số lớp e không đổi à lực hút giữa hạt nhân với e ngoài cùng tăng -> bán kính giảm -> khả năng nhường e giảm (Tính kim loại yếu dần) -> khả năng nhận thêm e tăng dần => tính phi kim mạnh dần
- Trong mỗi chu kì theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố yếu dần, đồng thời tính phi kim mạnh dần.
2. Sự biến đổi tính chất trong một nhóm A
Trong 1 nhóm A khi đi từ trên xuống : Z+ tăng dần và số lớp e cũng tăng à bán kính nguyên tử tăng và chiếm ưu thế hơn à khả năng nhường e tăng à tính kim loại tăng và khả năng nhận e giảm => tính phi kim giảm.
=> Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim giảm dần.
Kết luận :
Tính kim loại - phi kim biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt nhân.
3. Độ âm điện
a. Khái niệm
Độ âm điện của một nguyên tố đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
b. Bảng độ âm điện
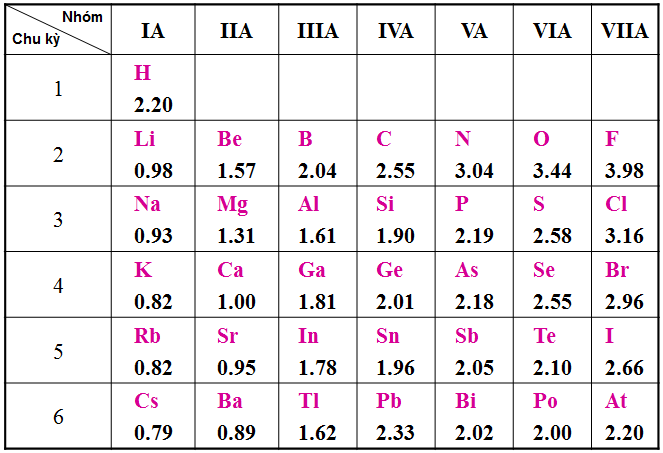
- Trong một chu kì, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân thì độ âm điện tăng dần.
- Trong một nhóm A, đi từ trên xuống theo chiều tăng dần của điện tích hạt nhân thì độ âm điện giảm dần.
Kết luận : Vậy độ âm điện của các nguyên tố biến đổi tuần hoàn theo chiều tăng dần của Z+.
II. HÓA TRỊ CỦA CÁC NGUYÊN TỐ
- Trong chu kì 3 đi từ đi từ trái sang phải, hóa trị cao nhất của các nguyên tố đối với oxi tăng từ 1 đến 7 còn hóa trị trong hợp chất khí đối với hiđro giảm từ 4 đến 1
- Trong chu kì hóa trị cao nhất của các nguyên tố đối với oxi tăng dần và hiđro giảm dần.
III. OXIT VÀ HIDROXIT CỦA CÁC NGUYÊN TỐ NHÓM A THUỘC CÙNG CHU KỲ
- Trong 1 chu kì: từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, tính bazơ của oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
Trong 1 nhóm A : Đi từ trên xuống, theo chiều tăng dần điện tích hạt nhân : tính bazơ của các oxit và hidroxit tăng, tính axit giảm dần.
IV. ĐỊNH LUẬT TUẦN HOÀN
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử

.jpg)
.jpg)




.jpg)
.jpg)




















