I. KHÁI NIỆM, PHÂN LOẠI
1. Khái niệm
Khi thay thế nguyên tử hidro của phân tử hidrocacbon bằng nguyên tử halogen ta được dẫn xuất halogen của hidrocacbon.
Thay thế nhóm -OH trong phân tử ancol bằng nguyên tử Halogen
C2H5OH + HBr → C2H5Br + H2O
Cộng hợp hidro halogenua hoặc halogen vào phân tử hidrocacbon không no.
CH2=CH2 + HBr → CH3-CH2-Br
CH2=CH2 + Br2 → 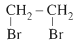
Thế nguyên tử hidro của hidrocacbon bằng nguyên tử halogen
CH4 + Cl2 → CH3Cl + HCl (Điều kiện: ánh sáng)
2. Phân loại
Các dẫn xuất halogen được phân loại dựa vào bản chất của halogen,số lượng nguyên tử halogen và đặc điểm cấu tạo của hidrocacbon
Một số koại dẫn xuất halogen thường gặp:
- Dẫn xuất halogen của hidrocacbon no, mạch hở. VD: CH3Cl (metyl clorua); CH2Cl-CH2Cl (1, 2- đicloetan)
- Dẫn xuất halogen của hidrocacbon không no, mạch hở. VD: CH2=CHCl
- Dẫn xuất của hidrocacbon thơm. VD: C6H5Br (Phenyl bromua)
Bậc của dẫn xuất halogen bằng bậc của nguyên tử C liên kết với nguyên tử halogen
Bậc I:![]() (Etyl clorua)
(Etyl clorua)
Bậc II: 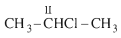 (isopropyl clorua)
(isopropyl clorua)
Bậc III: 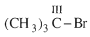 (tert-butyl bromua)
(tert-butyl bromua)
II. TÍNH CHẤT VẬT LÝ
Ở điều kiện thường, một số chất có phân tử khối nhỏ (CH3Cl, CH3F, ...) ở trạng thái khí. Các dẫn xuất có phân tử khối lớn hơn ở trạng thái lỏng và rắn.
Hầu như không tan trong nước, tan tốt trong các dung môi hữu cơ như hidrocacbon, ete, ...
Một số dẫn xuất halogen có hoạt tính sinh học cao như CF3-CHClBr (halotan: chất gây mê, không độc), DDT (thuốc diệt côn trùng)
III. TÍNH CHẤT HÓA HỌC
1. Phản ứng thế nguyên tử halogen bằng nhóm –OH
Phương trình tổng quát: R-X + NaOH .png) R-OH + NaX
R-OH + NaX
Đun nhẹ hỗn hợp etyl bromua trong dung dịch NaOH, đồng thời lắc đều. Sau một thời gian thu được hỗn hợp đồng nhất, do đã xảy ra phản ứng:
CH3-CH2-Br + NaOH ![]() C2H5OH + NaBr
C2H5OH + NaBr
2. Phản ứng tách hidrohalogennua
Đun sôi hỗn hợp gồm etyl bromua, kali hidroxit và etanol thấy có khí không màu thoát ra:
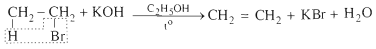
IV. ỨNG DỤNG
1. Làm nguyên liệu cho tổng hợp hữu cơ
Vinylclorua tổng hợp nhựa PVC

Ống PVC và ống PVC màu
Isopren tổng hợp cao su Isopren
CF2=CF2 tổng hợp tefon
.png)
Dụng cụ nấu ăn chống dính
Tổng hợp ancol, phenol…
2. Làm dung môi
Clorofom ; 1,2- đicloetan…
3. Các lĩnh vực khác
Thuốc trừ sâu, diệt côn trùng, thuốc gây mê.

.jpg)
.jpg)




.jpg)
.jpg)




















