I. HIỆN TƯỢNG ĐIỆN LI
1. Thí nghiệm
Chuẩn bị ba cốc : cốc a đựng nước cất, cốc b đựng dung dịch saccarozơ (đường kính trắng tinh khiết), cốc c đựng dung dịch NaCl rồi lắp vào bộ dụng cụ như hình 1.1.
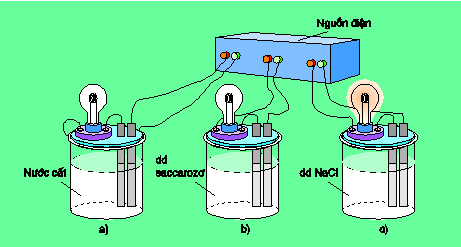
Khi nối các đầu dây dẫn điện với nguồn điện, ta thấy chỉ bóng đèn ở cốc đựng dung dịch NaCl bật sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozơ không dẫn điện.
Nếu làm các thí nghiệm tương tự, người ta thấy NaCl rắn, khan, NaOH rắn, khan, các dung dịch ancol etylic, glixerol không dẫn điện. Ngược lại các dung dịch axit, bazơ và muối đều dẫn điện.
2. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nước
Ngay từ năm 1887, A-rê-ni-ut đã chứng minh rằng, tính dẫn điện của các dung dịch axit, bazơ và muối là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion.
Như vậy các axit, bazơ và muối khi hoà tan trong nước điện li ra các ion, nên dung dịch của chúng dẫn điện.
Quá trình điện li các chất trong nước ra ion là sự điện li. Những chất tan trong nước điện li ra ion được gọi là những chất điện li.(*)
Vậy axit, bazơ và muối là những chất điện li.
(*) Nhiều chất khi nóng chảy cũng điện li ra ion, nên ở trạng thái nóng chảy các chất này dẫn điện được. Trong một số tài liệu, người ta cũng đề cập đến chất điện li loại này, thí dụ Al2O3.
II. CƠ CHẾ CỦA QUÁ TRÌNH ĐIỆN LI
1. Cấu tạo của phân tử H2O
Phân tử H2O có cậu tạo như hình 1.2. Liên kết O - H là liên kết cộng hóa trị phân cực, cặp electron dùng chung lệch về phía oxi, nên ở oxi có dư điện tích âm, còn ở hidro có dư điện tích dương. Vì vây, phân tử H2O là phân tử có cực

2. Quá trình điện li của NaCl trong nước
NaCl là hợp chất ion, nghĩa là gồm những cation Na+ và anion Cl- liên kết với nhau bằng lực tĩnh điện. Khi cho NaCl tinh thể vào nước, những ion Na+ và Cl- trên bề mặt tinh thể hút về chúng các phân tử H2O (cation hút đầu âm và anion hút đầu dương). Quá trình tương tác giữa các phân tử nước phân cực và các ion của muối kết hợp với sự chuyển động hỗn loạn không ngừng của các phân tử nước làm cho các ion Na+ và Cl- của muối tách dần khỏi tinh thể và hoà tan trong nước (hình 1.3).
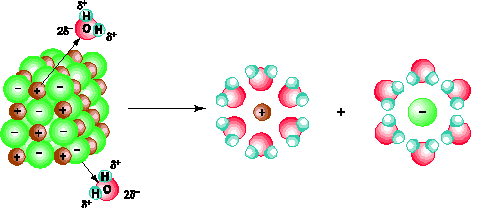
Hình 1.3. Sơ đồ quá trình điện li ra ion của tinh thể NaCl trong nước.
Từ sơ đồ trên ta thấy sự điện li của NaCl trong nước có thể được biểu diễn bằng phương trình điện li như sau :
NaCl (dd) -> Na+ (dd) + Cl- (dd)
Tuy nhiên, để đơn giản người ta thường viết :
NaCl -> Na+ + Cl-
3. Quá trình điện li của HCl trong nước
Phân tử hiđro clorua (HCl) cũng là phân tử phân cực tương tự phân tử nước. Cực dương ở phía hiđro, cực âm ở phía clo.
Khi tan trong nước, các phân tử HCl hút về chúng những cực ngược dấu của các phân tử nước. Do sự tương tác giữa các phân tử nước và phân tử HCl, kết hợp với sự chuyển động không ngừng của các phân tử nước dẫn đến sự điện li phân tử HCl ra các ion H+ và Cl- (hình 1.4).
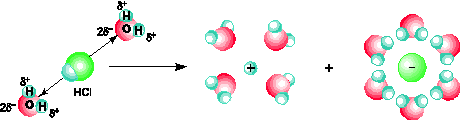
Hình 1.4. Sơ đồ quá trình điện li ra ion của phân tử HCl trong nước.
Phương trình điện li của HCl trong nước như sau :
HCl -> H+ + Cl-
Trong các phân tử ancol etylic, saccarozơ, glixerol, có sự phân cực nhưng rất yếu, nên dưới tác dụng của các phân tử nước chúng không thể điện li thành ion được, chúng là các chất không điện li.

.jpg)
.jpg)




.jpg)
.jpg)










