Theo điều kiện lượng tử hóa không những năng lượng electron trong nguyên tử chỉ có thể có những giá trị nhất định mà cả đám mây electron cũng không thể có hình dạng bất kỳ
Trái lại, hình dạng của đám mây electron được xác định hoàn toàn bằng số lượng tử orbital l.
Số lượng tử orbital (hay còn gọi là số lượng tử phụ hoặc phương vị) cũng có những giá trị nguyên, dương, tuy nhiên số giá trị của nó bị ràng buộc bởi số lượng tử chính n. Thực vậy, đối với mỗi giá trị của n, số lượng tử orbital có những giá trị từ 0 đến (n-1):
l = 0,1,2,3..., (n-1)
Ví dụ: với n = 1 có 1 giá trị là l = 0
n = 2 có 2 giá trị là l = 0 và 1
n = 3 có 3 giá trị là l = 0, 1 và 2
Như vậy, ứng với mỗi giá trị của n có n giá trị khác nhau của l.
Đối với nguyên tử nhiều electron thì các trạng thái năng lượng của những electron ở cùng mức năng lượng không phải hoàn toàn giống nhau mà có khác nhau chút ít do chịu ảnh hưởng của nhiều yếu tố mới xuất hiện và được đặc trưng bằng số lượng tử orbital l. Người ta gọi trạng thái năng lượng của electron được đặc trưng bằng giá trị nhất định của l là phân mức năng lượng. Trị số của l càng lớn thì phân mức năng lượng có giá trị càng cao. Những electron trong mỗi lớp lượng tử có cùng phân mức năng lượng họp thành phân lớp lượng tử hay phân lớp electron. Các phân lớp lượng tử (hoặc các phân mức năng lượng) được ký hiệu bằng chữ cái thường như sau
Từ đây trong mỗi lớp electron có n phân lớp electron.
Trạng thái của electron trong nguyên tử tương ứng với những giá trị nhất định của các số lượng tử n và l được biểu diễn bằng tổ hợp của giá trị số lượng tử n và của ký hiệu số lượng tử l như sau: 1s, 2s, 2p, 3s 3d, 4f....
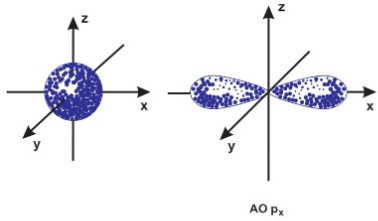
Số lượng tử orbital l xác định hình dạng đám mây electron, nghĩa là ứng với mỗi giá trị của l đám mây electron có hình dạng nhất định. Theo kết quả tính toán của cơ học lượng tử thì các đám mây electron tương ứng trạng thái s (l=0) có dạng khối cầu, tương ứng trạng thái p (l=1) có dạng 2 khối cầu biến dạng tiếp xúc nhau, tương ứng với trạng thái l =2 có dạng bốn khối cầu biến dạng tiếp xúc nhau....Các đám mây ứng với các trạng thái f, g.. có hình dạng phức tạp hơn nhiều.

.jpg)
.jpg)




.jpg)
.jpg)




















