I. CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ NHÓM A
Nhóm A gồm các nguyên tố thuộc chu kì nhỏ và chu kì lớn. Chúng là các nguyên tố s và nguyên tố p
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A
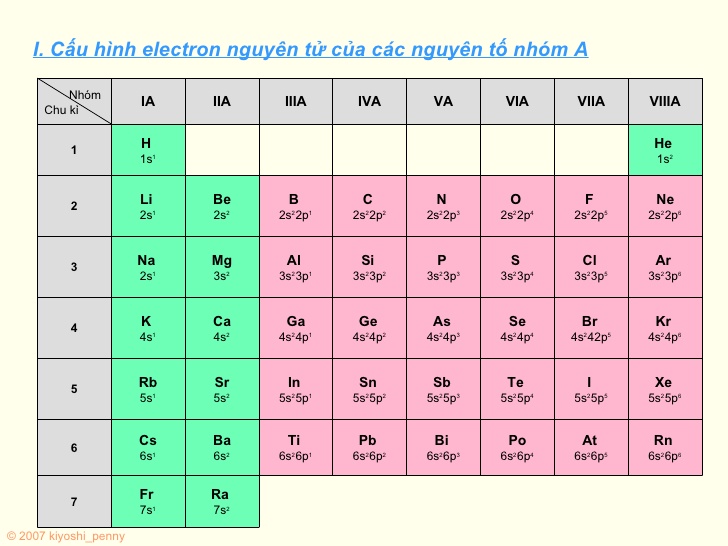
Nhận xét
Nguyên tử của các nguyên tố trong một nhóm A có số electron lớp ngoài cùng bằng nhau. Sự giống nhau về cấu hình electron lớp ngoài cùng là nguyên nhân của sự giống nhau về tính chất hoá học của các nguyên tố trong một nhóm A. Số thứ tự của nhóm (IA,IIA,....) cho biết số electron hoá trị của nguyên tử các nguyên tố trong nhóm đồng thời cũng là số electron lớp ngoài cùng của nguyên tử nguyên tố. Do đó biết số thứ tự của nhóm, ta có thể xác định được số electron lớp ngoài cùng. Thí dụ Al ở nhóm IIIA, có 3 electron ở lớp ngoài cùng, Al thuộc chu kì 3, có ba lớp electron do vậy cấu hình electron lớp ngoài cùng của nguyên tử Al sẽ là 3s23p1.
Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại, ta nói rằng chúng biến đổi tuần hoàn.
Vậy : Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
II. CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ NHÓM B
CÁc nguyên tố nhóm B đều thuộc chu kì lớn. Chúng là các nguyên tố d và nguyên tố f, còn được gọi là các kim loại chuyển tiếp.
Từ bảng tuần hoàn các nguyên tố hoá học, chúng ta nhận thấy :
Từ chu kì 4 trở đi, trong mỗi chu kì, sau khi bão hoà phân lớp ngoài cùng ns2, các electron tiếp theo được phân bố vào phân lớp (n−1)d thuộc lớp sát ngoài cùng. Cấu hình electron nguyên tử của các nguyên tố này thường có dạng (n−1)da ns2. Ở đây a là số electron được điền vào phân lớp sát ngoài cùng (n−1)d từ a=1 đến a=10, trừ một vài trường hợp ngoại lệ.
Thí dụ : Chu kì 4 có 10 nguyên tố d. Riêng hai nguyên tố là Cr(Z=24):3d54s1 và Cu(Z=29):3d104s1 có cấu hình chung là 3da4s1;8 nguyên tố d còn lại đều có cấu hình 3da4s2. Thí dụ Fe(Z=26):3d64s2
Nói chung, các nguyên tố d hoặc f có số electron hoá trị nằm ở lớp ngoài cùng hoặc ở cả phân lớp sát ngoài cùng chưa bão hoà, khi phân lớp sát ngoài cùng đã bão hoà thì số electron hoá trị được tính theo số electron ở lớp ngoài cùng.
Thí dụ : Ag(Z=47):[Kr]4d105s1 có số electron hoá trị bằng 1 vì phân lớp 4d đã bão hoà.

.jpg)
.jpg)




.jpg)
.jpg)










