I. TÍNH CHẤT VẬT LÝ
Ở điều kiện thường, Clo là chất khí màu vàng lục, mùi xốc, rất độc.
Khí Clo nặng gấp 2,5 lần không khí và tan ít trong nước tạo thành dung dịch nước Clo có màu vàng nhạt , Clo tan nhiều trong các dung môi hữu cơ: Benzen,…

II. TÍNH CHẤT HÓA HỌC
Cấu hình electron: 1s2 2s2 2p6 3s2 3p5
Cl + 1e → Cl-
=> Clo có tính chất oxi hóa mạnh
1. Tác dụng với kim loại tạo ra muối clorua
Ví dụ:
2Fe + 3Cl2 →(to) 2FeCl3
2. Tác dụng với hiđro
Clo dễ dàng phản ứng với hiđro khi có ánh sáng
Cl2 + H2 →(đk: as) 2HCl (khí hiđro clorua)
Kết luận: khí tác dụng với kim loại hoặc hiđro clo thể hiện tính oxi hóa mạnh
3. Tác dụng với nước
Cl2 + H2O ⥩ HCl + HClO (axit hipo clorơ)
Khi tác dụng với H2O, Clo đóng vai trò vừa là chất khử cũng vừa là chất oxi hóa.
III. TRẠNG THÁI TỰ NHIÊN
Trong tự nhiên Cl có 2 đồng vị 35Cl và 37Cl, nguyên tử khối trung bình là 35,5.
Cl chủ yếu tồn tại dưới dạng hợp chất như muối clorua, muối khoáng cacnalit.
IV. ỨNG DỤNG
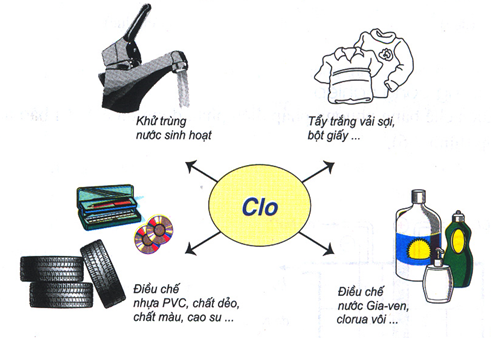
Khử trùng nước, tẩy trắng vải sợi, giấy,…
Sản xuất chất hữu cơ.
Sản xuất nước Giaven, clorua vôi,
 V. ĐIỀU CHẾ
V. ĐIỀU CHẾ
1. Phương pháp điều chế Clo trong phòng thí nghiệm: Đun nóng nhẹ dung dịch axit clorua đậm đặc với chất có khả năng oxy hóa mạnh như mangan dioxit (MnO2).
Phương trình phản ứng xảy ra như sau:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Nếu muốn thu được khí Clo tinh khiết, cần tiếp tục thực hiện các bước sau:
- Cho khí Clo qua bình axit sulfuric đặc, nó sẽ được làm khô nước.
- Thu khí Clo bằng phương pháp đẩy không khí do khí Clo nặng hơn không khí.
- Sử dụng bông tẩm xút, tránh khí Clo bay ra bên ngoài vì Clo là khí độc
Ngoài ra có thể dùng một số chất oxy hóa khác như kali pemanganat (KMnO4), Kali Clorat (KClO3), Clorua vôi (CaOCl2).
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
2. Điều chế khí Clo trong công nghiệp
Điều chế Clo trong phòng thí nghiệm chỉ thu được một lượng nhỏ, không đủ phục vụ cho nhiều ứng dụng trong cuộc sống. Do đó, điều chế công nghiệp là việc rất cần thiết. Các nhà sản xuất tiến hành điện phân muối Natri Clorua bằng điện phân nóng chảy theo phương trình phản ứng:
2NaCl → 2Na + Cl2
Hoặc điện phân có màng ngăn dung dịch muối halogenua (natri clorua)
2NaCl + 2H2O → H2 + 2NaOH + Cl2

.jpg)
.jpg)




.jpg)
.jpg)




















