A. Axit nitric (HNO3)
I − CẤU TẠO PHÂN TỬ
Phân tử HNO3 có cấu tạo : 
Trong hợp chất HNO3, nguyên tố nitơ có số oxi hoá cao nhất là +5.
II − TÍNH CHẤT VẬT LÝ
• Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí
ẩm, khối lượng riêng bằng 1,53 g/cm3, sôi ở 86oC. Axit nitric không bền lắm : khi đun nóng bị phân huỷ một phần theo phương trình :
4HNO3 → 4NO2 + O2 + 2H2O
Khí này tan trong dung dịch axit làm dung dịch có màu vàng
• Axit nitric tan trong nước theo bất kì tỉ lệ nào. Trên thực tế thường dùng loại axit đặc có nồng độ 68%, D = 1,40 g/cm3.
III − TÍNH CHẤT HÓA HỌC
1. Tính axit
Axit nitric là một trong số các axit mạnh nhất, trong dung dịch loãng nó phân li hoàn toàn thành H+ và NO3−
Dung dịch HNO3 làm quỳ tím đổi thành màu đỏ, tác dụng với oxit bazơ, bazơ và muối của axit yếu hơn tạo thành muối nitrat. Thí dụ :
CuO + 2HNO3 → Cu(NO3)2 + H2O
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
2. Tính oxi hoá
Axit nitric là một trong những axit có tính oxi hoá mạnh. Tuỳ thuộc vào nồng độ của axit và bản chất của chất khử mà HNO3 có thể bị khử đến một số sản phẩm khác nhau của nitơ.
a) Với kim loại
Do ion NO3− trong phân tử HNO3 có khả năng oxi hoá mạnh hơn ion H+, nên HNO3 oxi hoá được hầu hết các kim loại, kể cả các kim loại có tính khử yếu như Cu, Ag,..., trừ Au và Pt. Khi đó, kim loại bị oxi hoá đến mức oxi hoá cao nhất và tạo ra muối nitrat.
Khi tác dụng với kim loại có tính khử yếu như Cu, Pb, Ag,... HNO3 đặc bị khử đến NO2 (hình 2.8), còn HNO3 loãng bị khử đến NO. Thí dụ :
Cu +4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O.
3Cu+8HNO3 → 3Cu(NO3)2+4H2O+2NO.
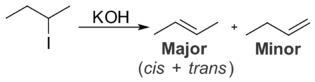
Hình 2.8. Phản ứng của Cu với HNO3 đặc tạo ra khí NO2 màu nâu đỏ
Khi tác dụng với những kim loại có tính khử mạnh như Mg, Zn, Al,... HNO3 loãng có thể bị khử đến N2O, N2 hoặc NH4NO3 Thí dụ:
8Al + 30HNO3 → 15H2O +3N2O+8Al(NO3)3
10HNO3 + 4Zn → 3H2O + NH4NO3 + 4Zn(NO3)2
• Fe, Al bị thụ động hoá trong dung dịch HNO3 đặc, nguội vì tạo nên một màng oxit bền trên bề mặt các kim loại này, bảo vệ cho kim loại không tác dụng với axit nitric và những axit khác mà trước đó chúng tác dụng dễ dàng.
b) Với phi kim
Khi đun nóng, axit nitric đặc có thể oxi hoá được nhiều phi kim như C, S, P,... Khi đó, các phi kim bị oxi hoá đến mức oxi hoá cao nhất, còn HNO3 bị khử đến NO2 hoặc NO tuỳ theo nồng độ của axit. Thí dụ :
6HNO3 + S → 2H2O + H2SO4 + 6NO2
c) Với hợp chất
Khi đun nóng, axit nitric có thể oxi hoá được nhiều hợp chất như H2S, HI, SO2, FeO, muối sắt (II),... Thí dụ :
3H2S + 2HNO3 → 4H2O + 2NO + 3S
Nhiều chất hữu cơ bị phá huỷ hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
IV − ỨNG DỤNG
HNO3 là một trong những hoá chất cơ bản quan trọng. Phần lớn HNO3 sản xuất trong công nghiệp được dùng để điều chế phân bón NH4NO3. Axit HNO3 còn được dùng để sản xuất thuốc nổ (thí dụ trinitrotoluen TNT,...), thuốc nhuộm, dược phẩm.
V − ĐIỀU CHẾ
1. Trong phòng thí nghiệm
HNO3 đƯợc điều chế bằng cách cho natri nitrat hoặc kali nitrat tác dụng với HNO3 đặc, nóng :
NaNO3(r) + H2SO4(đặc) → HNO3 + NaHSO4
Hơi HNO3 thoát ra được dẫn vào bình, được làm lạnh và ngưng tụ ở đó (hình 2.9). Phương pháp này chỉ được dùng để điều chế một lượng nhỏ HNO3 bốc khói.

Hình 2.9. Điều chế HNO3 đặc trong phòng thí nghiệm
2. Trong công nghiệp
HNO3 được sản xuất từ amoniac. Quá trình sản xuất gồm ba giai đoạn :
• Oxi hoá khí amoniac bằng oxi không khí ở nhiệt độ 850 − 900o C, có mặt chất xúc tác là hợp kim platin (Pt) và iriđi (Ir) :
4NH3 + 5O2 → 4NO + 6H2O ; ΔH = − 907 kJ
Phản ứng này tỏa nhiệt và xảy ra gần như hoàn toàn
• Oxi hoá NO thành NO2. Hỗn hợp chứa NO được làm nguội và cho hoá hợp với oxi không khí tạo thành khí nitơ đioxit :
2NO + O2 → 2NO2
• Chuyển hoá NO2 thành HNO3. Cho hỗn hợp nitơ đioxit vừa tạo thành và oxi tác dụng với nước, sẽ thu được dung dịch axit nitric :
4NO2 + 2H2O + O2 → 4HNO3
Dung dịch HNO3 thu được có nồng độ không vượt quá 52 − 68%. Để làm tăng nồng độ của HNO3, người ta chưng cất dung dịch HNO3 này với H2SO4 đậm đặc trong các thiết bị đặc biệt. Khi đó thu được dung dịch HNO3 có nồng độ cao hơn.
B. MUỐI NITRAT
Muối nitrat là muối của axit nitric. Thí dụ, natri nitrat (NaNO3), đồng (II) nitrat (Cu(NO3)2),...
I − TÍNH CHẤT CỦA MUỐI NITRAT
1. Tính chất vật lí
Tất cả các muối nitrat đều tan nhiều trong nước và là chất điện li mạnh. Trong dung dịch, chúng phân li hoàn toàn thành các ion. Ion NO3− không có màu, nên màu của một số muối nitrat là do màu của cation kim loại của muối tạo nên. Thí dụ Cu(NO3)2 có màu xanh.
Một số muối nitrat như NaNO3, NH4NO3 ... hấp thụ hơi nước trong không khí nên dễ bị chảy rữa.
2. Tính chất hoá học
Các muối nitrat kém bền với nhiệt, chúng bị phân huỷ khi đun nóng. Độ bền nhiệt của muối nitrat phụ thuộc vào bản chất của cation kim loại tạo muối.
• Nói chung, muối nitrat của các kim loại hoạt động mạnh (kali, natri,...) bị phân huỷ thành muối nitrit và oxi :
Thí dụ : 2KNO3→ to 2KNO2 + O2
• Muối nitrat của magie, kẽm, sắt, chì, đồng,... bị phân huỷ thành oxit kim loại tương ứng, NO2 và O2 :
Thí dụ : 2Mg(NO3)2→to 2MgO + 4NO2 + O2
• Muối nitrat của bạc, vàng, thuỷ ngân,... bị phân huỷ thành kim loại tương ứng, khí NO2 và O2.
Thí dụ : 2AgNO3 →to 2Ag + 2NO2 + O2
Ở hiệt độ cao, muối nitrat phân huỷ ra oxi nên chúng là các chất oxi hoá mạnh. Khi cho than nóng đỏ vào muối kali nitrat nóng chảy, than bùng cháy. Hỗn hợp muối nitrat nóng chảy và chất hữu cơ dễ bắt cháy và cháy mạnh.
3. Nhận biết ion nitrat
Trong môi trường trung tính, ion NO3− không có tính oxi hoá. Khi có mặt ion H+, ion NO3− thể hiện tính oxi hoá giống như HNO3. Vì vậy để nhận ra ion người ta đun nóng nhẹ dung dịch chứa NO3− với đồng kim loại và H2SO4 loãng :
3Cu + 8H+ + 2NO3 - → 3Cu2+ + 2NO + 4H2O
2NO + O2 → 2NO2
Phản ứng tạo dung dịch màu xanh và khí màu nâu đỏ thoát ra
II − ỨNG DỤNG CỦA MUỐI NITRAT
Các muối nitrat được sử dụng chủ yếu để làm phân bón hoá học (phân đạm) trong nông nghiệp, thí dụ NH4NO3, NaNO3, KNO3, Ca(NO3)2.
Kali nitrat còn được sử dụng để chế thuốc nổ đen (thuốc nổ có khói). Thuốc nổ đen chứa 75% KNO3, 10% S và 15% C.
C. CHU TRÌNH CỦA NITO TRONG TỰ NHIÊN
Nguyên tố nitơ rất cần cho sự sống trên Trái Đất. Trong tự nhiên luôn luôn diễn ra các quá trình chuyển hoá nitơ từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín
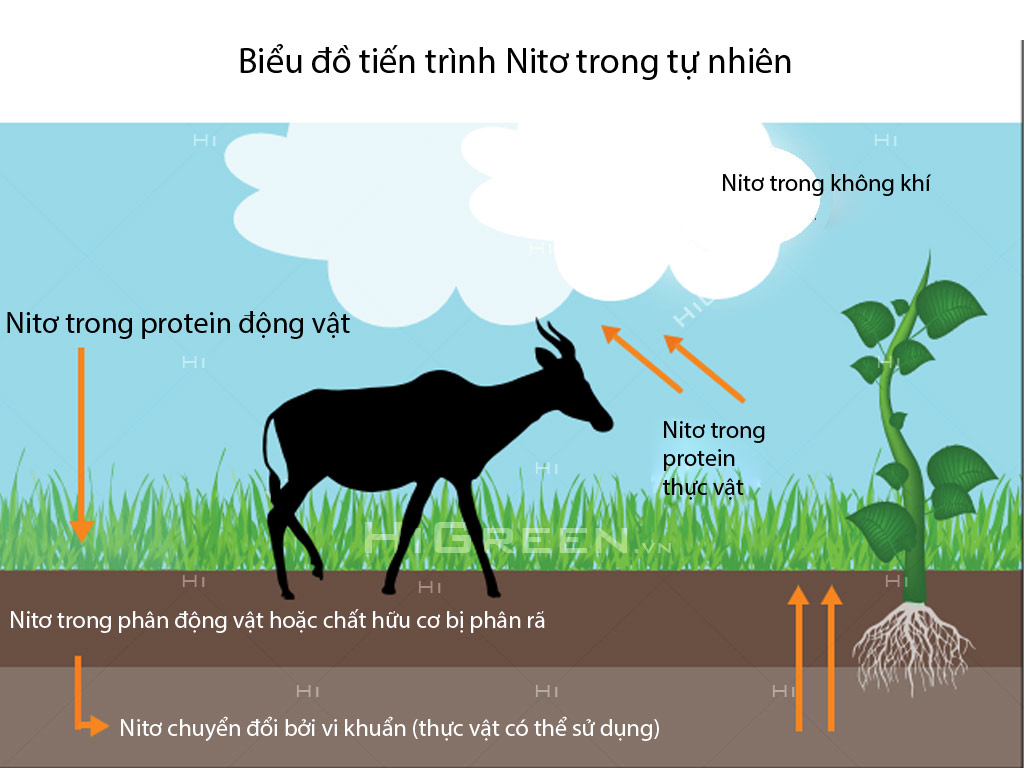
1. Cây xanh đồng hoá nitơ chủ yếu ở dạng muối nitrat và muối amoni, chuyển hoá thành protein thực vật. Động vật đồng hoá protein thực vật, tạo ra protein động vật. Các chất thải do động vật bài tiết ra (phân, nước tiểu,...) cũng như xác động vật khi chết đi lại chuyển thành hợp chất hữu cơ chứa nitơ. Nhờ những loại vi khuẩn khác nhau có trong đất, một phần các hợp chất này chuyển hoá thành amoniac, rồi thành muối nitrat, phần còn lại thoát ra ở dạng nitơ tự do bay vào khí quyển. Khi các chất hữu cơ (than gỗ, than đá, than bùn,...) bị đốt cháy, nitơ tự do cũng được thoát ra. Do các quá trình trên mà lượng nitrat trong đất dần dần bị cạn kiệt, đất đai trở nên cằn cỗi và cây cối sẽ khó phát triển.
2. Trên thực tế, có một số quá trình tự nhiên cho phép bù lại một phần lượng nitơ bị mất.
• Trong mưa giông, khi có sự phóng điện do sấm sét một phần nitơ tự do trong khí quyển kết hợp với oxi tạo thành khí NO, rồi chuyển hoá thành HNO3 và theo nước mưa thấm vào đất. HNO3 chuyển thành muối nitrat khi kết hợp với muối cacbonat, thí dụ canxi cacbonat, có trong đất.
• Một số loại vi khuẩn, đặc biệt là các vi khuẩn cố định đạm sống ở rễ cây họ đậu có khả năng hấp thụ nitơ từ khí quyển và chuyển hoá thành các hợp chất chứa nitơ.
3. Để tăng năng suất mùa màng, lượng nitơ chuyển từ khí quyển vào đất vẫn không thể đủ. Người ta ước tính lượng nitrat tái sinh tự nhiên chỉ bằng một nửa lượng nitrat bị hấp thụ. Do đó, cần phải bón vào đất những hợp chất chứa nitơ dưới dạng các loại phân bón hữu cơ và vô cơ.

.jpg)
.jpg)




.jpg)
.jpg)




















