I. HÓA TRỊ
1. Hóa trị trong hợp chất Ion
- Trong các hợp chất ion , hóa trị của 1 nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
Ví dụ: Trong hợp chất NaCl , Na có điện hóa trị 1+ và Cl có điện hóa trị 1– . Trong hợp chất CaF , Ca có điện hóa trị 2+ và F có điện hóa trị 1–
- Người ta quy ước , khi viết điện hóa trị của nguyên tố , ghi giá trị điện tích trước, dấu của điện tích sau.
- Các nguyên tố kim loại thuộc nhóm IA , IIA , IIIA có số electron ở lớp ngoài cùng là 1, 2, 3 có thể nhường nên có điện hóa trị là 1+ , 2+ , 3+
- Các nguyên tố phi kim thuộc nhóm VIA , VIIA nên có 6, 7 electron lớp ngoài cùng , có thể nhận thêm 2 hay 1 electron vào lớp ngoài cùng , nên có điện hóa trị 2– , 1–
2. Hóa trị trong hợp chất cộng hóa trị
Trong hợp chất cộng hóa trị: hóa trị của một nguyên tố được xác định bằng số liên kết của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hóa trị của nguyên tố đó.
VD: Phân tử H2O (H – O – H) nguyên tố H có cộng hóa trị 1, nguyên tố O có cộng hóa trị 2.
II. SỐ OXI HÓA
Số oxi hóa của nguyên tố là một số đại số được gán cho nguyên tử của nguyên tố đó theo các quy tắc sau:
Quy tắc 1: Trong các đơn chất, số oxi hóa của nguyên tố bằng 0
Quy tắc 2: Trong một phân tử, tổng số số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0
Quy tắc 3: Trong ion đơn nguyên tử, số oxi hóa của nguyên tố bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích của ion.
Quy tắc 4: Trong hầu hết các hợp chất, số oxi hóa của hiđro bằng +1, trừ một số trường hợp như hiđrua kim loại (NaH, CaH2 …). Số oxi hóa của oxi bằng – 2, trừ trường hợp OF2, peoxit(chẳng hạn H2O2)….
Cách viết số oxi hóa: được viết bằng chữ số thường, dấu đặt phía trước và được đặt trên kí hiệu nguyên tố
Ví dụ: 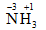

.jpg)
.jpg)




.jpg)
.jpg)




















