I - SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ BẰNG CẶP ELECTRON CHUNG
1. Sự hình thành phân tử đơn chất
a) Sự hình thành phân tử H2
Nguyên tử H(Z=1) có cấu hình electron là 1s1, hai nguyên tử H liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron tạo thành một cặp electron chung trong phân tử H2. Như thế trong phân tử H2, mỗi phân tử có 2 electron, giống cấu hình electron bền vững của khí hiếm heli:
H. + .H→ H:H
Mỗi chấm bên kí hiệu nguyên tố biểu diễn một electron ở lớp ngoài cùng, H:H được gọi là công thức electron. Thay hai chấm bằng 1 gạch, ta có H−H gọi là công thức cấu tạo.Giữa 2 nguyên tử hiđro có 1 cặp electron liên kết biểu thị bằng một gạch (−), đó là liên kết đơn.
b) Sự hình thành phân tử N2
Cấu hình electron nguyên tử của N(Z=7) là 1s22s22p3, có 5 electron ở lớp ngoài cùng.
Trong phân tử nitơ N2, để đạt cấu hình electron của nguyên tử khí hiếm gần nhất (Ne), mỗi nguyên tử nitơ phải góp chung 3 electron.
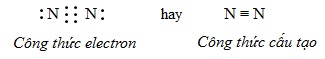
Hai nguyên tử nitơ liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng ba gạch (≡), đó là liên kết ba. Liên kết ba này bền nên ở nhiệt độ thường, khí nitơ rất bền, kém hoạt động hóa học.
Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
Các phân tử H2,N2 tạo nên từ hai nguyên tử của cùng một nguyên tố (có độ âm điện như nhau), nên các cặp electron chung không bị hút lệch về phía nguyên tử nào. Do đó, liên kết trong các phân tử đó không bị phân cực. Đó là liên kết cộng hóa trị không cực.
2. Sự hình thành phân tử hợp chất
a) Sự hình thành phân tử HCl
Trong phân tử hiđro clorua, mỗi nguyên tử (HvàCl) góp 1 electron tạo thành 1 cặp electron chung để tạo nên một liên kết cộng hóa trị. Độ âm điện của clo là 3,16 lớn hơn độ âm điện của hiđro là 2,20 nên cặp electron liên kết bị lệch về phía clo, liên kết cộng hóa trị này bị phân cực.
Trong công thức electron của phân tử có cực, người ta đặt cặp electron chung lệch về phía kí hiệu của nguyên tử có độ âm điện lớn hơn. Thí dụ: H:Cl
Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
b) Sự hình thành phân tử CO2 (có cấu tạo thẳng)
Cấu hình electron nguyên tử của C(Z=6) là 1s22s22p2, nguyên tử cacbon có 4 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử của O(Z=8) là 1s22s22p4, nguyên tử oxi có 6 electron ở lớp ngoài cùng.
Trong phân tử CO2, nguyên tử C nằm giữa 2 nguyên tử O và góp chung với mỗi nguyên tử O hai electron, mỗi nguyên tử O góp chúng với nguyên tử C hai electron tạo ra 2 liên kết đôi. Ta có:
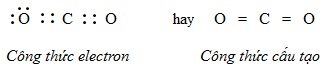
Như vậy, mỗi nguyên tử C hay O đều có 8 electron ở lớp ngoài cùng, đạt cấu hình bền vững của khí hiếm. Độ âm điện của oxi (3,44) lớn hơn độ âm điện của C(2,55) nên cặp electron chung lệch về phía oxi. Liên kết giữa hai nguyên tử oxi và cacbon là phân cực, nhưng phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O) triệt tiêu nhau, kết quả là toàn bộ phân tử không bị phân cực.
c) Liên kết cho - nhận
Trong một số trường hợp, cặp electron chung chỉ do một nguyên tử đóng góp thì liên kết giữa hai nguyên tử là liên kết cho - nhận.
Thí dụ: Đối với phân tử SO2 công thức electron, công thức cấu tạo có thể biểu diễn như sau:

Nguyên tử S có 6 electron ở lớp ngoài cùng. Khi hình thành phân tử SO2, nguyên tử S đã dùng 2 electron độc thân góp chung với hai electron độc thân của một trong hai nguyên tử oxi. Nguyên tử S sử dụng một cặp electron để dùng chung với nguyên tử oxi còn lại. Trong công thức cấu tạo, người ta biểu diễn cặp electron chung bằng một gạch nối, cặp electron cho - nhận bằng một mũi tên có chiều hướng về phía nguyên tử nhận.
3. Tính chất của các chất có liên kết cộng hóa trị
Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn như đường, lưu huỳnh, iot,..., có thể là chất lỏng: nước, ancol,... hoặc chất khí như khí cacbonic, clo, hiđro,... Các chất có cực như ancol etylic, đường,... tan nhiều trong dung môi có cực như nước. Phần lớn các chất không cực như iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua,...
Nói chung, các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
II - LIÊN KẾT CỘNG HÓA TRỊ VÀ SỰ XEN PHỦ CÁC OBITAN NGUYÊN TỬ
1. Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử đơn chất
a) Sự hình thành phân tử H2
Để hình thành liên kết giữa hai nguyên tử H trong phân tử hiđro, hai obitan 1s của hai nguyên tử H xen phủ với nhau tạo ra vùng xen phủ giữa hai hạt nhân nguyên tử. Xác suất có mặt của các electron tập trung chủ yếu ở khu vực giữa hai hạt nhân.Vì vậy, ngoài lực đẩy tương hỗ giữa hai proton và hai electron còn có lực hút giữa các electron vơi hai hạt nhân hướng về tâm phân tử (hình 3.2).
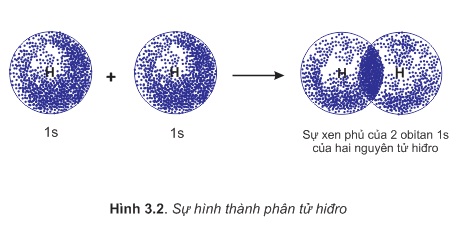
Khi hai hạt nhân có khoảng cách d=0,074nm, các lực hút và lực đẩy cân bằng nhau (d được gọi là khoảng cách cân bằng hay độ dài của liên kết H−H).
Ở khoảng cách cân bằng trên, phân tử H2 có năng lượng thấp hơn tổng năng lượng của hai nguyên tử riêng rẽ.
Đó là nguyên nhân của sự hình thành liên kết cộng hóa trị giữa hai nguyên tử H và là một liên kết hóa học bền.
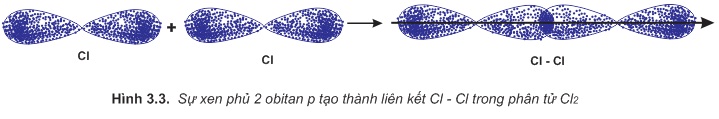
b) Sự hình thành phân tử Cl2
Để giải thích sự hình thành liên kết Cl−Cl, có thể dựa vào cấu hình electron của mỗi nguyên tử clo:
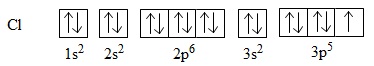
Sự hình thành liên kết giữa hai nguyên tử clo là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử clo (hình3.3).
2. Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử hợp chất
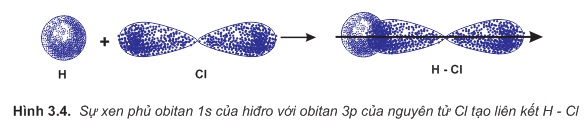
a) Sự hình thành phân tử HCl.
Liên kết hóa học trong phân tử hợp chất HCl được hình thành nhờ sự xenphủ giữa obitan 1s của nguyên tử hiđro và obitan 3p có 1 electron độc thân của nguyên tử clo (hình3.4).
b) Sự hình thành phân tử H2S
Sự hình thành phân tử H2S có thể mô tả bằng hình ảnh xen phủ giữa obitan 1s của các nguyên tử hiđro và 2 obitan p của nguyên tử lưu huỳnh. Lớp ngoài cùng của nguyên tử S có cấu hình electron 3s23p4.Trên 2 obitan p có 2 electron độc thân. Hai obitan này xen phủ với 2 obitan 1s có electron độc thân của 2 nguyên tử H tạo nên 2 liên kết S−H (hình3.5).


.jpg)
.jpg)




.jpg)
.jpg)




















