I- KHÁI NIỆM VÀ TÍNH CHẤT CỦA CHẤT GIẶT RỬA
1. Khái niệm chất giặt rửa
Chất giặt rửa là những chất khi dùng cùng với nước thì có tác dụng làm sạch các chất bẩn bám trên các vật rắn mà không gây ra phản ứng hóa học với các chất đó.
Từ cổ xưa, con người đã biết dùng các chất giặt rửa lấy trực tiếp từ thiên nhiên như: bồ kết, bồ hòn,...Trước khi hóa hữu cơ ra đời, người ta cũng đã biết nấu xà phòng từ dầu mỡ với các chất kiềm. Xà phòng chính là hỗn hợp các muối natri (hoặc kali) của các axit béo. Ngày nay người ta còn tổng hợp ra nhiều chất không phải là muối natri (hoặc kali) của các axit béo, nhưng có tác dụng giặt rửa tương tự xà phòng. Chúng được gọi là các chất giặt rửa tổng hợp và được chế thành các loại bột giặt, kem giặt,...
2. Tính chất giặt rửa
a) Một số khái niệm liên quan
Chất tẩy màu làm sạch các vết màu bẩn nhờ những phản ứng hóa học. Thí dụ: nước Gia-ven, nước clo oxi hóa chất màu thành chất không màu; SO2 khử chất màu thành chất không màu. Chất giặt rửa, như xà phòng làm sạch các vết bẩn không phải nhờ những phản ứng hóa học
Chất ưa nước là những chất tan tốt trong nước như: metanol, etanol, axit axetic, muối axetat kim loại kiềm,...
Chất kị nước là chất hầu như không tan trong nước như: hiđrocacbon, dẫn xuất halogen,...Chất kị nước lại ưa dầu mỡ, tức là tan tốt trong dầu mỡ. Chất ưa nước thì thường kị dầu mỡ, tức là không tan trong dầu mỡ.
b) Đặc điểm cấu trúc phân tử muối natri của axit béo
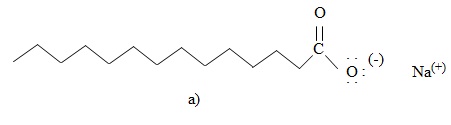
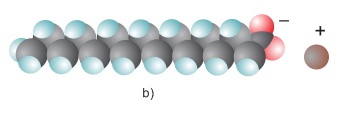
Hình: Cấu trúc phân tử muối natri stearat
a) Công thức cấu tạo thu gọn nhất; b) Mô hình đặc
Phân tử muối natri của các axit béo gồm một "đầu" ưa nước là nhóm COO−Na+ nối với một "đuôi" kị nước, ưa dầu mỡ là nhóm −CxHy (thường x≥15). Cấu trúc hóa học gồm một đầu ưa nước gắn với một đuôi dài ưa dầu mỡ là hình mẫu chung cho "phân tử chất giặt rửa".
c) Cơ chế hoạt động của chất giặt rửa
Lấy trường hợp natri stearat làm thí dụ, nhóm CH3[CH2]16−, "đuôi" ưa dầu mỡ của phân tử natri stearat thâm nhập vào vết dầu bẩn, còn nhóm COO−Na+ ưa nước lại có xu hướng kéo ra phía các phân tử nước. Kết quả là là vết dầu bẩn bị phân hủy thành những hạt rất nhỏ được giữ chặt bởi các phân tử natri stearat, không bám vào vặt rắn nữa mà phân tán vào nước rồi bị rửa trôi đi.

a) Sự định hướng các phân tử natri stearat khi tiếp xúc với nước và chất bẩn
b) Các hạt dầu rất nhỏ được giữ chặt bởi các phân tử natri stearat phân tán vào nước
II- XÀ PHÒNG
1. Sản xuất xà phòng
Phương pháp thông thường sản xuất xà phòng là đun dầu thực vật hoặc mỡ động vật (thường là loại không dùng để ăn) với dung dịch NaOH hoặc KOH ở nhiệt độ và áp suất cao. Sau khi phản ứng xà phòng hóa kết thúc, người ta cho thêm natri clorua vào và làm lạnh. Xà phòng tách ra khỏi dung dịch được cho thêm phụ gia và ép thành bánh. Dung dịch còn lại được loại tạp chất, cô đặc rồi li tâm tách muối natri clorua để lấy glixerol. Nhà máy Xà phòng Hà Nội sản xuất theo quy trình này.
Người ta còn sản xuất xà phòng bằng cách oxi hóa parafin của dầu mỏ nhờ oxi không khí, ở nhiệt độ cao, có muối mangan xúc tác, rồi trung hòa axit sinh ra bằng NaOH:
R−CH2−CH2−R′→R−COOH+R′−COOH→R−COONa+R′−COONa
Muối natri của các axit có phân tử khối nhỏ tan nhiều còn muối natri của các axit phân tử khối lớn không tan trong dung dịch natri clorua. Chúng được tách ra gọi là xà phòng tổng hợp. Xà phòng tổng hợp có tính chất giặt rửa tương tự xà phòng thường.
2. Thành phần của xà phòng và sử dụng xà phòng
Thành phần chính của xà phòng là các muối natri (hoặc kali) của axit béo, thường là natri stearat (C17H35COONa), natri panmitat (C15H31COONa), natri oleat (C17H33COONa),...Các chất phụ gia thường gặp là chất màu, chất thơm.
Xà phòng dùng trong tắm gội, giặt giũ,...có ưu điểm là không gây hại cho da, cho môi trường (vì dễ bị phân hủy bởi vi sinh vật có trong thiên nhiên). Xà phòng có nhược điểm là khi dùng với nước cứng (nước có chưa nhiều ion Ca2+ và Mg2+) thì các muối canxi stearat, canxi panmiat,...sẽ kết tủa làm giảm tác dụng giặt rửa và ảnh hưởng tới chất lượng vải sợi
III- CHẤT GIẶT RỬA TỔNG HỢP
1. Sản xuất chất giặt rửa tổng hợp
Để đáp ứng nhu cầu to lớn và đa dạng về chất giặt rửa, người ta đã tổng hợp ra nhiều chất dựa theo hình mẫu "phân tử xà phòng" (tức là gồm đầu phân cực gắn với đuôi dài không phân cực), chúng đều có tính chất giặt rửa tương tự xà phòng và được gọi là chất giặt rửa tổng hợp.
Thí dụ:
CH3[CH2]10−CH2−O−SO−3Na+ CH3[CH2]10−CH2−C6H4−SO−3Na+
natri laury sunfat natri đođecylbenzensunfonat
Chất giặt rửa tổng hợp được điều chế từ các sản phẩm dầu mỏ. Chẳng hạn oxi hóa parafin được axit cacboxylic, hiđro hóa axit thu được ancol, cho ancol phản ứng với H2SO4 rồi trung hòa thì được chất giặt rửa loại ankyl sunfat:
.png)
2. Thành phần và sử dụng các chế phẩm từ chất giặt rửa tổng hợp
Các chế phẩm như bột giặt, kem giặt, ngoài chất giặt rửa tổng hợp, chất thơm, chất màu ra, còn có thể có chất tẩy trắng như natri hipoclorit,...Natri hipoclorit có hại cho da khi giặt bằng tay.
Ưu điểm của chất giặt rửa tổng hợp là dùng được với nước cứng, vì chúng ít bị kết tủa bởi ion canxi. Những chất giặt rửa tổng hợp có chứa gốc hiđrocacbon phân nhánh gây ô nhiễm cho môi trường, vì chúng rất khó bị các sinh vật phân hủy.

.jpg)
.jpg)




.jpg)
.jpg)




















