I- KHÁI NIỆM
Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường.
Hậu quả là kim loại bị oxi hóa thành các ion dương bởi các quá trình hóa học hoặc điện hóa:
M→Mn++ne
II- HAI DẠNG ĂN MÒN KIM LOẠI
Căn cứ vào môi trường và cơ chế của sự ăn mòn kim loại, người ta phân thành hai dạng chính: ăn mòn hóa học và ăn mòn điện hóa
1. Ăn mòn hóa học
Ăn mòn hóa học thường xảy ra ở những bộ phận của thiết bị lò đốt hoặc những thiết bị thường xuyên phải tiếp xúc với hơi nước và khí oxi,...
Thí dụ:
3Fe+4H2O→to Fe3O4+4H2↑
2Fe+3Cl2→to 2FeCl3
3Fe+2O2→to Fe3O4
Như vậy: Ăn mòn hóa học là quá trìnhn oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
2. Ăn mòn điện hóa học
Ăn mòn điện hóa học là ăn mòn kim loại phổ biến và nghiêm trọng nhất trong tự nhiên.
a) Khái niệm về ăn mòn điện hóa học
Rót dung dịch H2SO4 loãng vào cốc thủy tinh rồi cắm hai lá kim loại khác nhau, thí dụ một lá Zn và một lá Cu vào cốc. Nối hai kim loại bằng một dây dẫn có mắc nối tiếp với một điện kế.
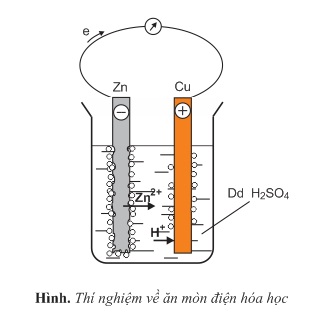
Hiện tượng:
- Khi chưa nối hai dây dẫn, lá Zn bị hòa tan và bọt hiđro thoát ra ở bề mặt lá Zn.
- Khi nối dây dẫn, lá zn bị ăn mòn nhanh trong dung dịch điện li, kim điện kế bị lệch, bọt khí H2 thoát ra cả ở lá Cu.
Giải thích:
- Khi chưa nối hai dây dẫn, kẽm bị ăn mòn hóa học do phản ứng oxi hóa kẽm bởi ion H+ trong dung dịch axit:
Zn+2H+→Zn2++H2
Bọt khí H2 sinh ra trên bề mặt lá Zn.
- Khi nối các thanh đồng và kẽm bằng một dây dẫn, một pin điện đã được hình thành (gọi là pin Vôn - ta), trong đó kẽm là cực âm, đồng là cực dương. Các electron di chuyển từ lá Zn sang lá Cu qua dây dẫn, tạo ra dòng điện một chiều. Dòng điện này làm cho kim điện kế bị lệch. Các ion H+ trong dung dịch H2SO4 di chuyển về lá Cu (cực dương) nhận electron (các electron này đã di chuyển từ cực kẽm sang cực đồng) bị khử thành H2 và sau đó thoát ra khỏi dung dịch:
2H++2e→H2(sựkhử)
Phản ứng điện hóa chung xảy ra trong pin:
Zn+2H+→Zn2++H2
Kết quả, lá Zn bị ăn mòn điện hóa đồng thời với sự tạo thành dòng điện. Quá trình ăn mòn như vậy được gọi là ăn mòn điện hóa học.
Như thế, ăn mòn điện hóa học là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
b) Điều kiện xảy ra ăn mòn điện hóa học
Từ thí nghiệm về ăn mòn điện hóa học, rút ra được những điều kiện sau:
Các điện cực phải khác nhau về bản chất, có thể là cặp hai kim loại khác nhau hoặc cặp kim loại - phi kim, hoặc cặp kim loại - hợp chất hóa học, thí dụ xementit Fe3C, trong đó kim loại có thế điện cực chuẩn nhỏ hơn là cực . Như vậy kim loại nguyên chất khó bị ăn mòn điện hóa học.
Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
Các điện cực cùng tiếp xúc với dung dịch chất điện li.
Thiếu 1 trong 3 điều kiện trên sẽ không xảy ra ăn mòn điện hóa học
Trong thực tế, các quá trình ăn mòn kim loại diễn ra rất phức tạp, có thể bao gồm cả sự ăn mòn hóa học và ăn mòn điện hóa. Nhưng ăn mòn điện hóa thường đóng vai trò chủ yếu.
c) Ăn mòn điện hóa học hợp kim của sắt (gang, thép) trong không khí ẩm.
Sự ăn mòn điện hóa học các hợp kim của sắt (gang, thép) trong không khí ẩm có ảnh hưởng đặc biệt nghiêm trọng đối với nền kinh tế của các quốc gia. Đây là một quá trình rất phức tạp, có thể mô tả một cách giản lược như sau:
Gang, thép là hợp kim Fe−C gồm những tinh thể Fe tiếp xúc trực tiếp với tinh thể C (graphit). Không khí ẩm có hòa tan khí CO2,O2,...tạo ra lớp dung dịch chất điện li phủ lên bề mặt gang, thép, làm xuất hiện vô số pin điện hóa mà Fe là cực âm, C là cực dương.
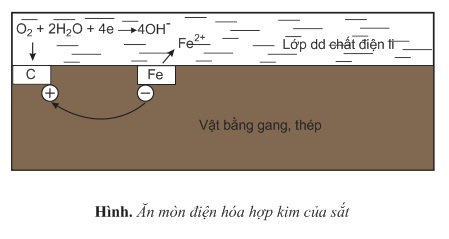
- Ở cực âm xảy ra sự oxi hóa: Fe→Fe2++2e
- Ở cực dương xảy ra sự khử: O2+2H2O+4e→4OH−
Ion Fe2+ tan vào dung dịch chất điện li có hòa tan khi oxi. Tại đây, ion Fe2+ tiếp tục bị oxi hóa dưới tác dụng của ion OH− tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O.
III- CHỐNG ĂN MÒN KIM LOẠI
Khối lượng kim loại bi ăn mòn trung bình hằng năm trên thế giới khoảng 20−25% khối lượng kim loại được sản xuất. Sự ăn mòn kim loại đã gây tổn thất to lớn về nhiều mặt cho nền kinh thế quốc dân và đời sống con người.
Có nhiều phương pháp bảo vệ kim loại khỏi bị ăn mòn. Phổ biến hơn cả là phương pháp bảo vệ bề mặt và bảo vệ điện hóa
1. Phương pháp bảo vệ bề mặt
Phương pháp bảo vệ bề mặt là phủ lên bề mặt kim loại một lớp sơn, dầu mỡ, chất dẻo hoặc tráng, mạ bằng một kim loại khác. Lớp bảo vệ bề mặt kim loại phải bền vững với môi trường và có cấu tạo đặc khít không cho không khí và nước thấm qua. Nếu lớp bảo vệ bị hư hỏng, kim loại sẽ bị ăn mòn.
2. Phương pháp điện hóa
Phương pháp bảo vệ điện hóa là dùng một kim loại làm vật hi sinh để bảo vệ vật liệu kim loại. Thí dụ: để bảo vệ vỏ tàu biển bằng thép, người ta gắn các lá Zn vào phía ngoài vỏ tàu ở phần chìm trong nước biển (nước biển là dung dịch chất điện li). Phần vỏ tàu bằng thép là cực dương, các lá Zn là cực âm.
- Ở anot (cực âm): Zn bị oxi hóa Zn→Zn2++2e
- Ở catot (cực dương): O2 bị khử 2H2O+O2+4e→4OH−
Kết quả là vỏ tàu được bảo vệ, Zn là vật hi sinh, nó bị ăn mòn. Nhưng tốc độ ăn mòn điện hóa của kẽm trong điều kiện này tương đối nhỏ và vỏ tàu được bảo vệ trong thời gian dài. Sau một thời gian nhất định, người ta thay những lá Zn bị ăn mòn bằng những lá Zn khác.

.jpg)
.jpg)




.jpg)
.jpg)




















