I - TÍNH CHẤT VẬT LÍ CỦA LƯU HUỲNH
1. Hai dạng thù hình của lưu huỳnh
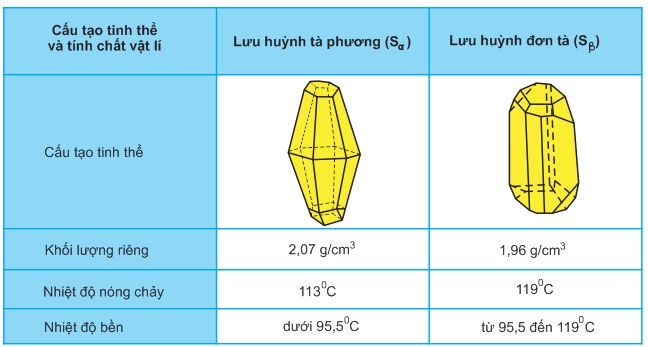
Lưu huỳnh có hai dạng thù hình: Lưu huỳnh tà phương Sα và lưu huỳnh đơn tà Sβ. Chúng khác nhau về cấu tạo tinh thể và một số tính chất vật lí, nhưng tính chất hóa học giống nhau.
Hai dạng lưu huỳnh Sα và Sβ có thể biến đổi qua lại với nhau theo điều kiện nhiệt độ (xem bảng sau).
2. Ảnh hưởng của nhiệt độ đối với cấu tạo phân tử và tính chất vật lí của lưu huỳnh
Thí nghiệm:
Cho một mẩu nhỏ lưu huỳnh vào ống nghiệm rồi đun trên ngọn lửa đèn cồn. Quan sát hiện tượng ta thấy:
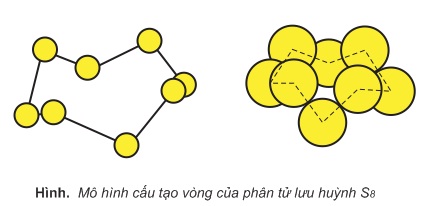
Ở nhiệt độ thấp hơn nhiệt độ nóng chảy (dưới 113oC), Sα và Sβ là chất rắn, màu vàng. Phân tử lưu huỳnh gồm 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng:
Ở nhiệt độ 119oC, lưu huỳnh nóng chảy thành chất lỏng màu vàng, rất linh động. Ở nhiệt độ này, các phân tử S8 chuyển động trượt trên nhau rất dễ dàng.
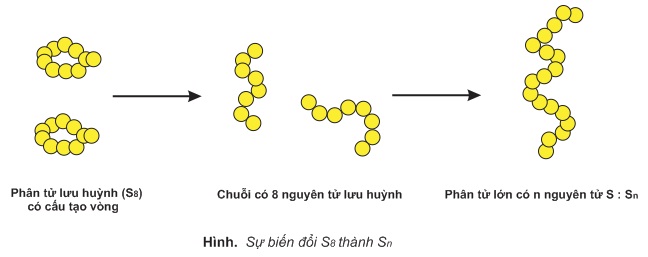
Ở nhiệt độ 187oC, lưu huỳnh lỏng trở nên quánh nhớt, có màu nâu đỏ. Ở nhiệt độ này, mạch vòng của phân tử S8 bị đứt gẫy tạo thành những chuỗi có 8 nguyên tử S. Những chuỗi này liên kết với nhau tạo thành phân tử lớn, chứa tới hàng triệu nguyên tử (Sn). Những phân tử Sn chuyển động rất khó khăn:
Ở nhiệt độ 445oC, lưu huỳnh sôi. Ở nhiệt độ này các phân tử lớn Sn bị đứt gẫy thành nhiều phân tử nhỏ bay hơi. Thí dụ, ở 1400oC hơi lưu huỳnh là những phân tử S2, ở nhiệt độ 1700oC hơi lưu huỳnh là những nguyên tử S.
Để đơn giản, người ta dùng kí hiệu S mà không dùng công thức phân tử S8 trong các phản ứng hóa học.
II - TÍNH CHẤT HÓA HỌC CỦA LƯU HUỲNH
Nguyên tử S có cấu hình electron là 1s22s22p63s23p4. Ở trạng thái cơ bản, nguyên tử S có 2 electron độc thân. Ở trạng thái kích thích, nguyên tử S có 4 hoặc 6 electron độc thân.
Bởi vậy, trong các hợp chất của S với những nguyên tố có độ âm điện nhỏ hơn (kim loại, hiđro...), nguyên tố S có số oxi hóa −2.
Trong các hợp chất cộng hóa trị của S với những nguyên tố có độ âm điện lớn hơn (oxi, clo...), nguyên tố S có số oxi hóa +4 hoặc +6.
Như vậy, đơn chất lưu huỳnh (số oxi hóa =0) có số oxi hóa trung gian giữa −2 và +6. Khi tham gia phản ứng hóa học, nó thể hiện tính oxi hóa hoặc tính khử.
1. Lưu huỳnh tác dụng với kim loại và hiđro
Lưu huỳnh tác dụng với nhiều kim loại và hiđro ở nhiệt độ cao, sản phẩm là muối sunfua hoặc hiđro sunfua
Lưu huỳnh tác dụng với thủy ngân ở nhiệt độ thương tạo muối thủy ngân (II) sunfua
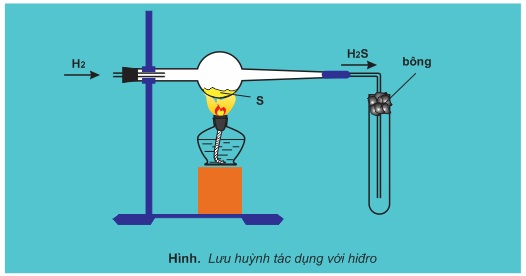
Trong những thí dụ trên, số oxi hóa của các nguyên tố S giảm từ 0 xuống −2. S thể hiện tính oxi hóa.
2. Lưu huỳnh tác dụng với phi kim
Ở nhiệt độ thích hợp, lưu huỳnh tác dụng được với một số phi kim như oxi, clo, flo
Trong những phản ứng trên, số oxi hóa của nguyên tố S tăng từ 0 đến +4 hoặc +6. S thể hiện tính khử.
III - ỨNG DỤNG CỦA LƯU HUỲNH
Lưu huỳnh là nguyên liệu quan trọng cho nhiều ngành công nghiệp:
- 90% lượng lưu huỳnh sản xuất được dùng để điều chế H2SO4.
- 10% lượng lưu huỳnh còn lại được dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,...
IV - SẢN XUẤT LƯU HUỲNH
1. Khai thác lưu huỳnh
Để khai thác lưu huỳnh dạng tự do trong lòng đất, người ta dung hệ thống thiết bị nén nước siêu nóng (170oC) vào mỏ lưu huỳnh để đẩy lưu huỳnh nóng chảy lên mặt đất (phương pháp Frasch).
2. Sản xuất lưu huỳnh từ hợp chất
Trong công nghiệp luyện kim màu, người ta thu được một lượng lớn sản phẩm phụ là SO2. Trong khí tự nhiên, người ta cũng tách ra được một lượng đáng kể khí H2S. Từ những khí này, điều chế ra lưu huỳnh.
a) Đốt H2S trong điều kiện thiếu không khí:
2H2S+O2→2S+2H2O
b) Dùng H2S khử SO2:
2H2S+SO2→3S+2H2O
Phương pháp này cho phép thu hồi trên 90% lượng lưu huỳnh có trong các khí thải độc hại SO2 và H2S.

.jpg)
.jpg)




.jpg)
.jpg)




















