I - TÍNH CHẤT VẬT LÍ
Hiđro clorua (HCl) là chất khí không màu, mùi xốc, nặng hơn không khí (d=36,5/29≈1,26).Trong không khí ẩm nó tạo thành các hạt nhỏ như sương mù. Hiđro clorua hóa lỏng ở −85,1oC và hóa rắn ở −114,2oC.
Hiđro clorua rất độc, nồng độ cho phép của hiđro clorua trong không khí là 0,005mg/l.
Để tìm hiểu tính tan của hiđro clorua trong nước, chúng ta quan sát thí nghiệm sau:
Lấy một bình thủy tinh trong suốt nạp đầy khí hiđro clorua, đậy bình bằng nút cao su có một ống thủy tinh vuốt nhọn xuyên qua. Nhúng một đầu ống thủy tinh vào cốc thủy tinh chứa nước có pha vài giọt dung dịch quỳ màu tím. Một lát sau, nước trong cốc theo phun vào bình thành những tia nước có màu đỏ.
Vì sao nước lại phun vào bình? Đó là do khí hiđro clorua tan rất nhiều vào nước làm giảm áp suất trong bình và nước bị hút vào bình. Quỳ tím chuyển thành màu đỏ chứng tỏ dung dịch có tính axit.
Như vậy, khí hiđro clorua tan nhiều trong nước tạo thành dung dịch axit. Ở 0oC, một thể tích nước hòa tan được gần 500 thể tích khí HCl. Dung dịch thu được gọi là dung dịch axit clohiđric.
Dung dịch axit clohiđric đặc là một chất lỏng không màu, mùi xốc, "bốc khói" trong không khí ẩm. Ở 20oC, dung dịch HCl đặc nhất có nồng độ 37% và có khối lượng riêng 1,19g/ml. Khi đun nóng dung dịch axit clohiđric đặc, đầu tiên hiđro clorua bay ra cùng với lượng nhỏ hơi nước. Đến khi nồng độ dung dịch còn 20,2% thì HCl và H2O tạo thành hỗn hợp đẳng phí, sôi ở 110oC.
II - TÍNH CHẤT HÓA HỌC
Khí hiđro clorua khô không làm quỳ tím đổi màu, không tác dụng được với CaCO3 để giải phóng khí CO2, tác dụng rất khó khăn với kim loại. Dung dịch hiđro clorua trong benzen cũng có tính chất tương tự hiđro clorua khô.
Dung dịch hiđro clorua trong nước (dung dịch chứa axit clohiđric) là một dung dịch axit mạnh. Những tính chất chung của một axit (làm đỏ quỳ tím, tác dụng với bazơ, oxit bazơ, tác dụng với muối, tác dụng với kim loại) đều thể hiện rõ nét ở dung dịch axit HCl:
Mg(OH)2+2HCl→MgCl2+2H2O
CuO+2HCl→CuCl2+H2O
CaCO3+2HCl→CaCl2+H2O+CO2↑
Fe+2HCl→FeCl2+H2↑
Trong phân tử HCl, clo có số oxi hóa −1. Đây là trạng thái oxi hoá thấp nhất của clo. Do đó, HCl (ở thể khí và trong dung dịch) còn thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh. Thí dụ:
.png)
III - ĐIỀU CHẾ
1. Trong phòng thí nghiệm
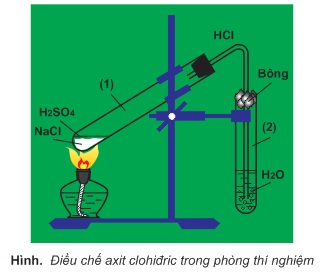
Người ta điều chế khí hiđro clorua từ NaCl rắn và axit sunfuric đậm đặc:
NaCl+H2SO4→NaHSO4+HCl
2NaCl+H2SO4→Na2SO4+2HCl
Phản ứng thứ nhất xảy ra ở nhiệt độ thường hoặc đun nóng không quá 250oC, phản ứng thứ hai xảy ra ở nhiệt độ cao hơn 400oC.
Hòa tan khí HCl vào nước cất, ta được dung dịch axit clohiđric.
2. Trong công nghiệp
a) Trong công nghiệp, người ta cũng sản xuất axit clohiđric từ NaCl và H2SO4 đặc. Phương pháp này gọi là phương pháp sunfat.
b) Để thu được HCl tinh khiết, người ta sản xuất HCl bằng phương pháp tổng hợp từ hiđro và clo (thu được khi điện phân dung dịch NaCl có màng ngăn).
Cần đốt để khơi mào cho phản ứng xảy ra trong buồng đốt T1 (làm bằng than chì hay thạch anh), sau đó phản ứng tự xảy ra (phản ứng tỏa nhiệt).
Khí HCl được nước hấp thụ ở hai tháp hấp thụ T2 và T3 theo nguyên tắc ngược dòng tạo ra dung dịch axit clohiđric đặc.
c) Ngày nay, một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các chất hữu cơ (chủ yếu là các hiđrocacbon).
IV - MUỐI CỦA AXIT CLOHIĐRIC. NHẬN BIẾT ION CLORUA
1. Muối của axit clohiđric
Muối clorua là muối của axit clohiđric.
Đa số muối clorua dễ tan trong nước, một vài mưới clorua hầu như không tan, đó là AgCl,PbCl2,CuCl,HgCl2 (riêng PbCl2 tan khá nhiều trong nước nóng).
Một số muối clorua dễ bay hơi ở nhiệt độ cao như đồng (II) clorua, sắt (III) clorua, thiếc (IV) clorua,...
Nhiều muối clorua có ứng dụng quan trọng. Natri clorua dùng làm muối ăn và nguyên liệu sản xuất cho clo, natri hiđroxit, axit clohiđric. Kali clorua dùng làm phân bón. Kẽm clorua dùng để chống mục gỗ và bôi lên bề mặt kim loại trước khi hàn vì nó có tác dụng tẩy gỉ, làm chắc mối hàn. Nhôm clorua là chất xúc tác quan trọng trong tổng hợp hữu cơ, bari clorua dùng để trừ sâu bệnh trong nông nghiệp,...
2. Nhận biết ion clorua
Hãy quan sát thí nghiệm: Nhỏ vài giọt dung dịch AgNO3 vào dung dịch muối clorua hoặc dung dịch HCl, ta thấy xuất hiện kết tủa màu trắng không tan trong các axit mạnh:
AgNO3+NaCl→AgCl↓+NaNO3
AgNO3+HCl→AgCl↓+HNO3
Dung dịch AgNO3 là thuốc thử để nhận biết ion clorua có trong dung dịch muối clorua hoặc dung dịch axit HCl.

.jpg)
.jpg)




.jpg)
.jpg)




















