I - SƠ LƯỢC VỀ CÁC OXIT VÀ CÁC AXIT CÓ OXI CỦA CLO
Tuy không tác dụng trực tiếp với oxi nhưng clo tạo ra một loạt oxit được điều chế bằng con đường gián tiếp. Thí dụ Cl2O,Cl2O7,... Clo cũng tạo ra các axit có oxi:
HClO : Axit hipoclorơ.
HClO2: Axit clorơ.
HClO3: Axit cloric.
HClO4: Axit pecloric.
So sánh độ âm điện của clo và oxi, ta dễ dàng hiểu được vì sao trong các hợp chất có oxi của clo, clo có số oxi hóa dương.
Sự biến đổi tính chất trong dãy axit có oxi của clo được biểu thị bằng sơ đồ sau:

Trong dãy này, axit hipoclorơ là chất oxi hóa mạnh nhất, axit pecloric là chất oxi hóa yếu nhất. Ngược lại, axit hipoclorơ là axit yếu nhất (yếu hơn cả axit cacbonic) còn axit pecloric là axit mạnh nhất.
Các muối của những axit nói trên có nhiều ứng dụng trong thực tế, trong đó thường gặp nhất là nước Gia-ven, clorua vôi và muối clorat.
II - NƯỚC GIA-VEN, CLORUA VÔI, MUỐI CLORAT
1. Nước Gia-ven
Chúng ta đã biết khí clo tác dụng với dung dịch NaOH loãng nguội tạo thành dung dịch hỗn hợp natri clorua và natri hipoclorit, đó là nước Gia-ven (Javel).
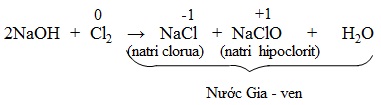
Khi điện phân dung dịch natri clorua (xem bài clo), nếu tạo điều kiện cho khí clo thoát ra tác dụng với dung dịch NaOH tạo thành khi điện phân (bể điện phân không có vách ngăn), ta thu được nước Gia-ven. Đó là phương pháp điều chế nước Gia-ven.
Là muối của một axit rất yếu, natri hipoclorit trong nước Gia-ven dễ tác dụng với cacbon đioxit của không khí tạo thành axit hipoclorơ.
NaClO+CO2+H2O → NaHCO3+HClO
Do có tính oxi hóa mạnh, axit hipoclorơ có tác dụng sát trùng , tẩy trắng sợi, vải, giấy.
Nước Gia-ven có tính oxi hóa mạnh được dùng để tẩy trắng sợi, vải, giấy. Nó cũng được dùng để sát trùng và tẩy uế nhà vệ sinh hoặc những khu vực bị ô nhiễm khác.
2. Clorua vôi
Khi cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở 30oC, ta thu được clorua vôi:
Ca(OH)2+Cl2 → CaOCl2+H2O
Clorua vôi
Công thức cấu tạo của clorua vôi là:
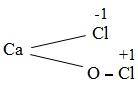
Như vậy, clorua vôi là muối của kim loại canxi với hai gốc axit là clorua (Cl−) và hipoclorit (ClO−). Muối của một kim loại với nhiều loại gốc axit khác nhau được gọi là muối hỗn tạp.
Clorua vôi là chất bột màu trắng, có mùi xốc của khí clo. Cũng như natri hipoclorit, clorua vôi có tính oxi hóa mạnh. Khi tác dụng với axit clohiđric, clorua vôi giải phóng khí clo:
CaOCl2+2HCl→CaCl2+Cl2+H2O
Trong không khí ẩm, clorua vôi tác dụng với cacbon đioxit, làm thoát ra axit hipoclorơ:
2CaOCl2+CO2+H2O → CaCO3+CaCl2+2HClO
So với nước Gia-ven, clorua vôi rẻ tiền hơn, có hàm lượng hipoclorit cao hơn, dễ bảo quản và dễ chuyên chở hơn.
Clorua vôi cũng được dùng để tẩy trắng sợi, vải, giấy, để tẩy uế các hố rác, cống rãnh. Do có khả năng tác dụng với nhiều chất hữu cơ, clorua vôi được dùng để xử lí các chất độc. Một lượng lớn clorua vôi được dùng trong việc tinh chế dầu mỏ.
3. Muối clorat
Clorat là muối của axit cloric (HClO3). Muối clorat quan trọng hơn cả là kali clorat (KClO3).
a) Điều chế
Nếu cho khí clo tác dụng với dung dịch kiềm nóng thì phản ứng không tạo ra muối hipoclorit mà tạo ra muối clorat
Kali clorat còn được điều chế bằng cách điện phân dung dịch KCl25% ở nhiệt độ 70oC−75oC.
b) Tính chất
Kali clorat là chất rắn kết tinh, không màu, nóng chảy ở 356oC. Nó tan nhiều trong nước nóng nhưng ít tan trong nước lạnh. Vì thế, khi làm lạnh dung dịch bão hòa, KClO3 dễ dàng khỏi dung dịch.
Khi đun nóng đến nhiệt độ trên 500oC (không có xúc tác), kali clorat rắn bị phân hủy:
Phản ứng này xảy ra ở nhiệt độ thấp hơn nếu có chất xúc tác MnO2 và được dùng để điều chế oxi trong phòng thí nghiệm.
Ở trạng thái rắn, kali clorat là chất oxi hóa mạnh. Photpho bốc cháy khi được trộn với kali clorat. Hỗn hợp kali clorat với lưu huỳnh và cacbon sẽ nổ khi đập mạnh.
c) Ứng dụng
Kali clorat được dùng để chế tạo thuốc nổ, sản xuất pháo hoa, ngòi nổ và những hỗn hợp dễ cháy khác. Kali clorat còn được dùng trong công nghiệp diêm. Thuốc ở đầu que diêm thường chứa gần 50%KClO3.

.jpg)
.jpg)




.jpg)
.jpg)




















