A. KIẾN THỨC CẦN NẮM VỮNG
I. CẤU TẠO, TÍNH CHẤT CỦA OXI VÀ LƯU HUỲNH
1. Cấu hình electron của nguyên tử
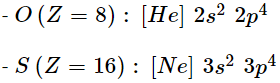
2. Độ âm điện
- Độ âm điện O = 3,44 > S = 2,58
3. Tính chất hóa học
a) Oxi và lưu huỳnh là những nguyên tố phi kim có tính oxi hóa mạnh: O > S
- Oxi oxi hóa hầu hết kim loại, nhiều phi kim, nhiều hợp chất.
- Lưu huỳnh oxi hóa nhiều kim loại, một số phi kim.
b) Khác với oxi, lưu huỳnh còn thể hiện tính khử khi tác dụng với những nguyên tố có độ âm điện lớn hơn như O, F.
II. TÍNH CHẤT CÁC HỢP CHẤT CỦA LƯU HUỲNH
1. Hiđro sunfua H2S
- Dung dịch H2S trong nước có tính axit yếu (axit sunfuhiđric).
- H2S có tính khử mạnh, khi tham gia phản ứng nó có thể bị oxi hóa thành S hoặc SO2
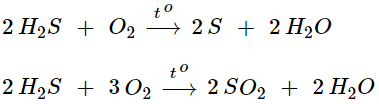
2. Lưu huỳnh đioxit SO2
- SO2 là oxit axit, tác dụng với H2O tạo thành dung dịch axit sunfurơ H2SO3.
- SO2 có tính oxi hóa khi tác dụng với chất khử mạnh hơn.
- SO2 có tính khử khi tác dụng với chất oxi hóa mạnh hơn.
3. Lưu huỳnh trioxit SO3 và axit sunfuric H2SO4
- SO3 là oxit axit, tác dụng với H2O tạo thành dung dịch axit sunfuric.
- H2SO4 loãng có tính chất chung của axit (làm quỳ tím hóa đỏ, tác dụng với kim loại trước H2, tác dụng với muối, tác dụng với oxit bazơ và bazơ).
- H2SO4 đặc có tính háo nước và tính oxi hóa mạnh, tính axit.

.jpg)
.jpg)




.jpg)
.jpg)




















