I - ĐỊNH NGHĨA, PHÂN LOẠI, ĐỒNG PHÂN VÀ DANH PHÁP
1. Định nghĩa
Ancol là những hợp chất hữu cơ mà phân tử có nhóm hiđroxyl (OH) liên kết trực tiếp với nguyên tử cacbon no.
Ancol quen thuộc với chúng ta là C2H5−OH, được gọi là ancol etylic hoặc etanol. Các ancol no, đơn chức, mạch hở hợp thành dãy đồng đẳng của ancol etylic có công thức chung là CnH2n+1OH(n≥1)
2. Phân loại
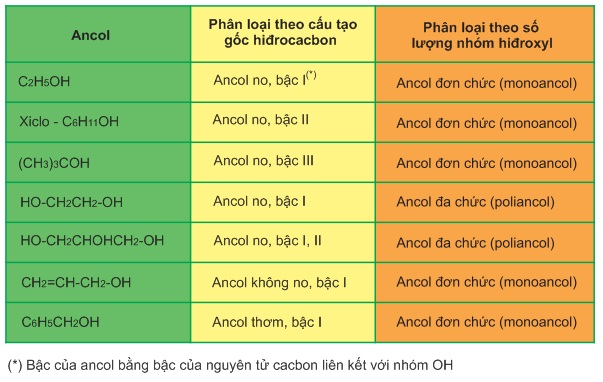
Ancol được phân loại theo cấu tạo gốc hiđrocacbon và theo số lượng nhóm hiđroxyl trong phân tử như thí dụ bảng dưới đây.
Bảng . Phân loại ancol
3 Đồng phân và danh pháp
a) Đồng phân
Ngoài đồng phân nhóm chức (chẳng hạn CH3CH2OH và CH3OCH3), ancol có đồng phân mạch cacbon và đồng phân vị trí nhóm chức. Thí dụ
CH3CH2CH2CH2OH CH3CH2CH(OH)CH3 (CH3)2CHCH2OH (CH3)3COH
ancol butylic ancol sec-butylic ancol isobutylic ancol tert-butylic
b) Danh pháp
Tên thông thường: Ancol + tên gốc hiđrocacbon + ic
Thí dụ:
CH3OH (CH3)2CHOH CH2=CHCH2OH C6H5CH2OH
ancol metylic ancol isopropylic ancol anlyric ancol benzylic
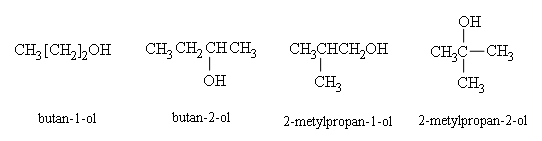
Tên thay thế: Tên hiđrocacbon tương ứng theo mạch chính + số chỉ vị trí + ol
Mạch chính được quy định là mạch cacbon dài nhất có chứa nhóm OH.
Số chỉ vị trí được bắt đầu từ phía gần nhóm OH hơn. Thí dụ:
II- TÍNH CHẤT VẬT LÍ VÀ LIÊN KẾT HIĐRO CỦA ANCOL
1. Tính chất vật lí
Hằng số vật lí của một số ancol thường gặp được ghi trong bảng 8.3
Bảng 8.3 Hằng số vật lí của một số ancol
.png)
Ở điều kiện thường, các ancol từ CH3OH đến khoảng C12H25OH là chât lỏng, từ khoảng C13H27OH trở lên là chất rắn.
Các ancol có từ 1 đến 3 nguyên tử C trong phân tử tan vô hạn trong nước. Khi số nguyên tử C tăng lên thì độ tan giảm dần.
Các poliol như etylen glicol, glixerol thường sánh, nặng hơn nước và có vị ngọt.
Các ancol trong dãy đồng đẳng của ancol etylic đều là những chất không màu.
2. Liên kết hiđro
a) Khái niệm về liên kết hiđro
Người ta nhận thấy rằng nhiệt độ nóng chảy, nhiệt độ sôi, độ tan trong nước của ancol đều cao hơn so với hiđrocacbon, dẫn xuất halogen hoặc ete có khối lượng mol phân tử chênh lệch nhau không nhiều.
Để giải thích điều đó, hãy so sánh sự phân cực ở nhóm C−O−H ancol và ở phân tử nước.
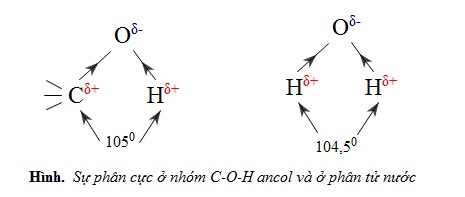
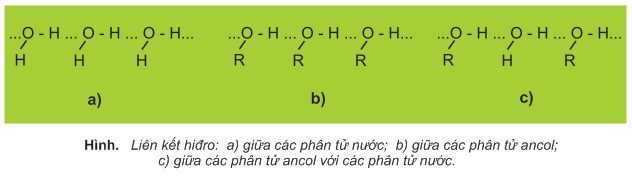
Nguyên tử mang một phần điện tích dương (δ+) của nhóm OH này khi ở gần nguyên tử O mang một phần điện tích âm (δ−) của nhóm OH kia thì tạo thành một liên kết yếu gọi là liên kết hiđro, biểu diễn bằng dấu "..." như hình dưới. Trong nhiều trường hợp, nguyên tử H liên kết cộng hóa trị với nguyên tử F,O hoặc N thường tạo thêm liên kết hiđro với các nguyên tử F,O hoặc N khác.
b) Ảnh hưởng của liên kết hiđro đến tính chất vật lí
Do có liên kết hiđro giữa các phân tử với nhau (liên kết hiđro liên phân tử), các phân tử ancol hút nhau mạnh hơn so với những phân tử có cùng phân tử khối nhưng không có liên kết hiđro (hiđrocacbon, dẫn xuất halogen, ete,... ).
Vì thế phải cung cấp nhiệt nhiều hơn để chuyển ancol từ trạng thái rắn sang trạng thái lỏng (nóng chảy) cũng như từ trạng thái lỏng sang trạng thái khí (sôi).
Các phân tử ancol nhỏ, một mặt có sự tương đồng với các phân tử nước, mặt khác lại có khả năng tạo liên kết hiđro với nước, nên có thể xen giữa các phân tử nước, "gắn kết" với các phân tử nước. Vì thế chúng hòa tan tốt trong nước.

.jpg)
.jpg)




.jpg)
.jpg)




















