I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Các nguyên tố hoá học được xếp vào một bảng, gọi là bảng tuần hoàn, dựa trên các nguyên tắc sau :
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
- Các nguyên tố cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
II. CẤU TẠO BẢNG TUẦN HOÀN
1. Ô nguyên tố
Mỗi nguyên tố hoá học được xếp vào một ô của bảng, gọi là ô nguyên tố. Số thứ tự của ô đúng bằng số hiệu nguyên tử của nguyên tố đó.
Thí dụ : Ô nguyên tố của nhôm
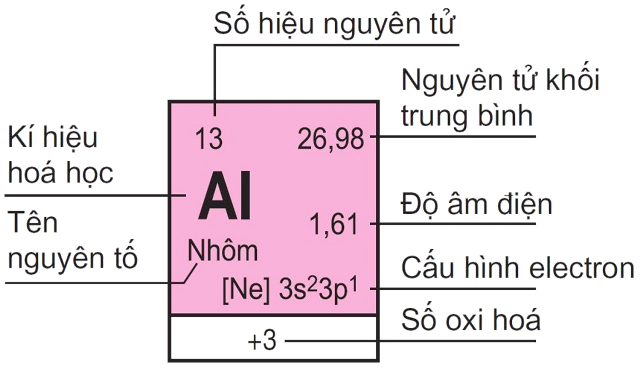
2. Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Bảng tuần hoàn gồm 7 chu kì được đánh số từ 1 đến 7. Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
Giới thiệu các chu kì :
Chu kì 1 : Gồm 2 nguyên tố là H(Z=1) và He(Z=2). Nguyên tử của chúng có một lớp electron (n=1) và các electron được phân bố vào phân lớp s như sau : H(1s1) và He(1s2)
Chu kì 2 : Gồm 8 nguyên tố, từ Li(Z=3) đến Ne(Z=10). Nguyên tử của chúng có 2 lớp electron (n=2) và các electron được phân bố vào các lớp như sau : Li(1s22s1) cho đến Ne(1s22s22p6)
Chu kì 3 : Gồm 8 nguyên tố, từ Na(Z=11) đến Ar(Z=18). Nguyên tử của chúng có 3 lớp electron (n=3) và các electron được phân bố vào các lớp như sau : Na(1s22s22p63s1) cho đến Ar(1s22s22p63s23p6)
Chu kì 4 : Gồm 18 nguyên tố từ K(Z=19 đến Kr(Z=36). Nguyên tử của chúng có 4 lớp electron (n=4). Việc phân bố electron ở chu kì này có đặc điểm là chưa phân bố vào phân lớp 3d mà phân bố vào lớp 4s cho đủ 2 electron ở nguyên tử kim loại kiềm K(Z=19):1s22s22p63s23p64s1 và kim loại kiềm thổ Ca(Z=20):1s22s22p63s23p64s2, sau đó mới phân bố electron tiếp tục vào phân lớp 3d từ 1 đến 10 electron cho các nguyên tử của 10 nguyên tố kim loại chuyển tiếp (từ Sc(Z=21) đến Zn(Z=30)). Tiếp theo là sự phân bố electron vào phân lớp 4p của các nguyên tử 6 nguyên tố từ Ga(Z=31) cho đến Kr(Z=36).
Chu kì 5 : Gồm 18 nguyên tố, từ Rb(Z=37) đến Xe(Z=54), sự phân bố electron cũng diễn ra tương tự chu kì 4
Chu kì 6 : Gồm 32 nguyên tố, từ Cs(Z=55) đến Rn(Z=86), sự phân bố electron diển ra phức tạp hơn.
Chu kì 7 : Bắt đầu từ nguyên tố Fr đến nguyên tố có số thứ tự 110(Z=110). Đây là một chu kì chưa hoàn thành.
Phân loại chu kì :
Các chu kì 1,2 và 3 là các chu kì nhỏ.
Các chu kì 4,5,6 và 7 là các chu kì lớn
3. Nhóm nguyên tố
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hoá học gần giống nhau và được sếp thành một cột.
Nguyên tử các nguyên tố trong cùng một nhóm có số electron hoá trị bằng nhau và bằng số thứ tự của nhóm (trừ một số ngoại lệ).
Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A đánh số từ IA đến VIIIA và 8 nhóm B đánh số từ IB đến VIIIB. Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột
- Khối các nguyên tố s gồm các nguyên tố nhóm IA và nhóm IIA
Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
Thí dụ :
Na(Z=11):1s22s22p63s1;K(Z=19):1s22s22p63s23p64s1
Mg(Z=12):1s22s22p63s2;Ca(Z=20):1s22s22p63s23p64s2
- Khối các nguyên tố p gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He).
Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
Thí dụ :
O(Z=8):1s22s22p4;S(Z=16):1s22s22p63s23p4
Ne(Z=10):1s22s22p6;Ar(Z=18):1s22s22p63s23p6
Các nhóm A bao gồm các nguyên tố s và nguyên tố p
- Khối các nguyên tố d gồm các nguyên tố thuộc các nhóm B
Nguyên tố d là các nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
- Khối các nguyên tố f gồm các nguyên tố xếp thành hai hàng ở cuối bảng. Chúng gồm có 14 nguyên tố họ Lantan (từ Ce(Z=58) đến Lu(Z=71)) và 14 nguyên tố họ Actini (từ (Z=90) đến Lr (Z=103))
Nguyên tố f là các nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
Các nhóm B bao gồm các nguyên tố d và nguyên tố f

.jpg)
.jpg)




.jpg)
.jpg)




















