I- KHÁI NIỆM, PHÂN LOẠI, DANH PHÁP VÀ ĐỒNG PHÂN
1. Khái niệm
Khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon ta được amin
Như vậy, trong phân tử amin, nguyên tử nitơ có thể liên kết với 1 hoặc 2 hoặc 3 gốc hiđrocacbon.
2. Phân loại
Amin được phân loại theo hai cách thông dụng nhất:
a) Theo đặc điểm cấu tạo của gốc hiđrocacbon.
Amin thơm (thí dụ: anilin C6H5NH2), amin béo (thí dụ: etylamin C2H5NH2) amin dị vòng
thí dụ: piroliđin 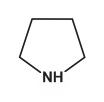
b) Theo bậc của amin
Bậc của amin được tính bằng số nguyên tử hiđro trong phân tử amoniac bị thay thế bởi gốc hiđrocacbon. Theo đó, các amin được phân loại thành: amin bậc một, bậc hai, bậc ba. Thí dụ:
CH3CH2CH2NH2 CH3CH2NHCH3 (CH3)3N
amin bậc một amin bậc hai amin bậc ba
3. Danh pháp
Tên của các admin được gọi theo danh pháp gốc - chức và danh pháp thay thế. Ngoài ra, một số amin được gọi theo tên thường (tên riêng) như ở bảng dưới. Nhóm NH2 khi đóng vai trò nhóm thế thì gọi là nhóm amino, khi đóng vai trò nhóm chức thì gọi là nhóm amin.
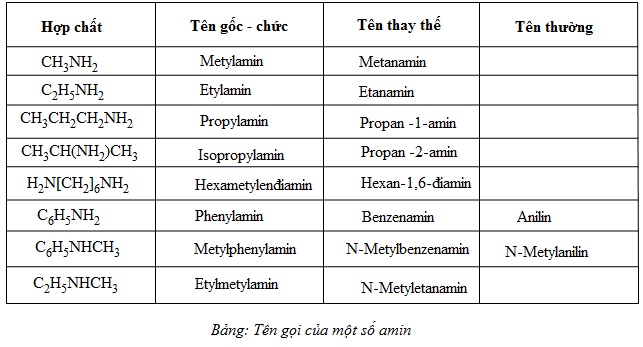
4. Đồng phân
Khi viết công thức các đồng phân cấu tạo của amin, cần viết đồng phân mạch C và đồng phân vị trí nhóm chức cho từng loại: amin bậc I, amin bậc II, amin bậc III.
Thí dụ, với C4H11N, ta viết được các amin đồng phân sau:
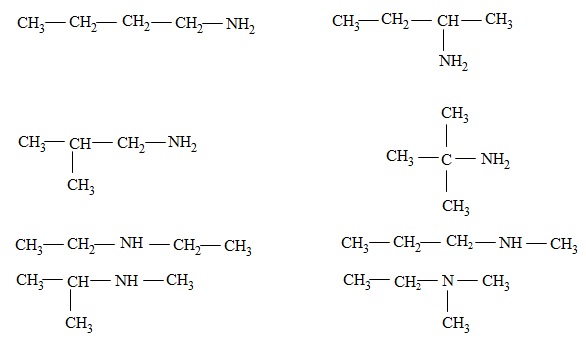
II- TÍNH CHẤT VẬT LÍ
Metyl -, đimetyl -, trimetyl - và etylamin là những chất khí, mùi khai khó chịu, độc, dễ tan trong nước. Các amin đồng đẳng cao hơn là những chất lỏng hoặc rắn, độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
Anilin là chất lỏng, sôi ở 184oC, không màu, rất độc, ít tan trong nước, tan trong etanol, benzen. Để lâu trong không khí, anilin chuyển sang màu nâu đen vì bị oxi hóa bởi oxi không khí.
III- CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT HÓA HỌC
Sự tương đồng về cấu tạo giữa amoniac, amin các bậc và anilin được thấy ở hình dưới. Mô hình của một vài phân tử được trình bày ở hình dưới.
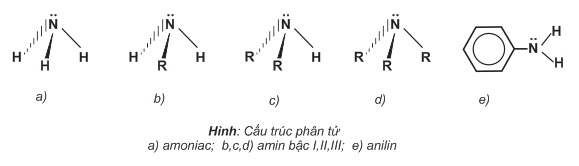
Mô hình của một vài phân tử được trình bày ở hình dưới.

Do phân tử amin có nguyên tử nitơ còn đôi electron chưa liên kết (tương tự như trong phân tử amoniac) nên amin thể hiện tính chất bazơ. Ngoài ra, nguyên tử nitơ trong phân tử amin có số oxi hóa - 3 như trong amoniac nên amin thường dễ bị oxi hóa. Các amin thơm, thí dụ như anilin, còn dễ dàng tham gia phản ứng thế vào nhân thơm do ảnh hưởng của đôi electron chưa liên kết ở nguyên tử nitơ.
1. Tính chất của chức amin
a) Tính bazơ
Thực nghiệm 1: Nhúng mẫu giấy quỳ tím vào ống nghiệm đựng dung dịch propylamin.
Hiện tượng: Mẫu giấy quỳ chuyển sang màu xanh.
Giải thích: Propylamin và nhiều amin khác khi tan trong nước tác dụng với nước cho ion OH−:
CH3CH2CH2+H2O ⇆ [CH3CH2CH2NH3]++OH−
Thực nghiệm 2: Đưa đũa thủy tinh vừa nhúng vào dung dịch HCl đậm đặc lên miệng lọ đựng dung dịch CH3NH2 đậm đặc.
Hiện tượng: Xung quanh đũa thủy tinh bay lên một làn khói trắng.
Giải thích: Khí metylamin bay lên gặp hơi axit HCl đã xảy ra phản ứng tạo ra muối:
CH3NH2 + HCl→ [CH3NH3]+Cl−
metylamin metylamoni clorua
Thực nghiệm 3: Nhỏ mấy giọt anilin vào nước, lắc kĩ. Anilin hầu như không tan, nó tạo vẩn đục rồi lắng xuống đáy. Nhúng mẫu giấy quỳ tím vào dung dịch anilin.Màu quỳ tím không đổi. nhỏ dung dịch HCl đặc vào ống nghiệm, anilin tan dần do đã xảy ra phản ứng.
C6H5NH2 + HCl→ C6H5NH+3Cl−
phenylamoni clorua
Nhận xét: Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein do kết hợp với proton mạnh hơn amoniac.
Anilin và các amin thơm ít tan trong nước. Dung dịch của chúng không làm đổi màu quỳ tím và phenolphtalein.
Như vậy, nhóm ankyl có ảnh hưởng làm tăng mật độ electron nguyên tử nitơ do đó làm tăng lực bazơ; nhóm phenyl (C6H5) làm giảm mật độ electron ở nguyên tử nitơ do đó làm giảm lực bazơ.
Lực bazơ:
CnH2n+1−NH2>H−NH2>C6H5−NH2
b) Phản ứng với axit nitrơ
Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ. Thí dụ:
C2H5NH2+HONO→C2H5OH+N2↑+H2O
Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0−50C) cho muối điazoni:
C6H5NH2+HONO+HCl→(0−5oC) C6H5N+2Cl−+2H2O
benzenđiazoni clorua
Muối điazoni có vai trò quan trọng trong tổng hợp hữu cơ, đặc biệt là tổng hợp phẩm nhuộm azo
c) Phản ứng ankyl hóa
Khi cho amin bậc một hoặc bậc hai tác dụng với ankyl halogenua, nguyên tử H của nhóm amin có thể bị thay thế bởi gốc ankyl. Thí dụ:
C2H5NH2+CH3I→C2H5NHCH3+HI
Phản ứng này được gọi là phản ứng ankyl hóa amin.
2. Phản ứng thế ở nhân thơm của anilin
Thí nghiệm: Nhỏ vài giọt nước brom vào ống nghiệm đựng sẵn 1ml dung dịch anilin.
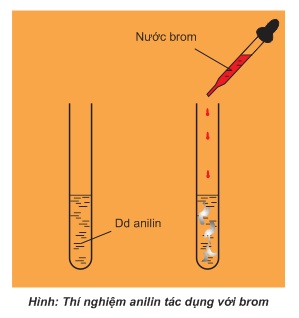
Hiện tượng: Xuất hiện kết tủa trắng
Giải thích: Do ảnh hưởng của nhóm NH2, (tương tự nhóm OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm NH2 trong nhân thơm của anilin đã bị thay thế bởi ba nguyên tử brom:
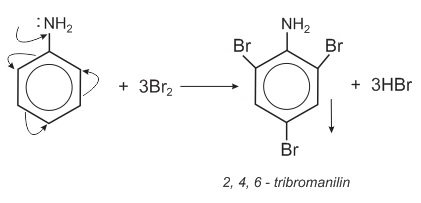
Phản ứng này dùng để nhận biết anilin.
IV- ỨNG DỤNG VÀ ĐIỀU CHẾ
1. Ứng dụng
Các ankylamin được dùng trong tổng hợp hữu cơ, đặc biệt là các điamin được dùng để tổng hợp polime.
Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm (phẩm azo, đen anilin,...), polime (nhựa anilin-fomanđehit,...), dược phẩm (streptoxit, sunfaguaniđin,...)
2. Điều chế
Amin có thể được điều chế bằng nhiều cách. Thí dụ:
a) Thay thế nguyên tử H của phân tử amoniac
Các ankylamin được điều chế từ amoniac và ankyl halogenua. Thí dụ:
.png)
b) Khử hợp chất nitrơ
Anilin và các amin thơm thường dùng được điều chế bằng cách khử nitrobenzen (hoặc dẫn xuất nitrơ tương ứng) bởi hiđro mới sinh nhờ tác dụng của kim loại (như Fe,Zn) với axit HCl. Thí dụ:
.png)
Ngoài ra, các amin còn có thể được điều chế bằng nhiều cách khác.

.jpg)
.jpg)




.jpg)
.jpg)




















