I. BÁN KÍNH NGUYÊN TỬ
Từ hình 2.1 sau đây cho thấy:
Trong một chu kì, tuy nguyên tử các nguyên tố có cùng số lớp electron, nhưng khi điện tích hạt nhân tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng theo, do đó bán kính nguyên tử nói chung giảm dần.
Trong một nhóm A, theo chiều từ trên xuống dưới, số lớp electron tăng dần, bán kính nguyên tử của các nguyên tố tăng theo, mặc dù điện tích hạt nhân tăng nhanh.
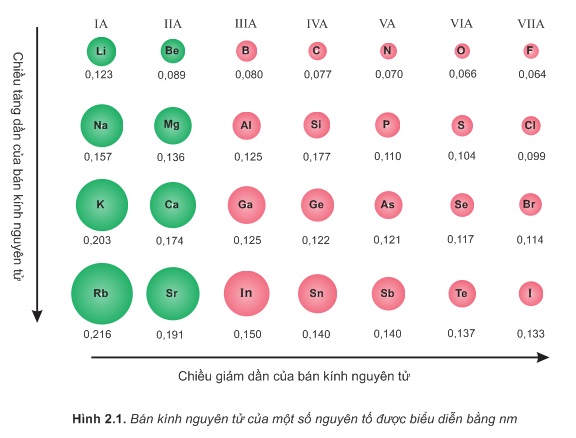
Vậy: Bán kính nguyên tử của các nguyên tố nhóm A biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
II. NĂNG LƯỢNG ION HÓA
Năng lượng ion hóa thứ nhất (I1) của nguyên tử là năng lượng tối thiểu cần để tách electron thứ nhất ra khỏi nguyên tử ở trạng thái cơ bản.
Năng lượng ion hóa được tính bằng kJ/mol.
Thí dụ: Để tách một mol electron ra khỏi một mol nguyên tử hiđro theo quá trình: H→H++e phải tiêu tốn một năng lượng bằng 1312kJ/mol.
Năng lượng ion hóa thứ 2, thứ 3 được kì hiệu là I2,I3 là năng lượng cần để tách electron thứ 2,3 ra các khỏi ion tương ứng. Giá trị của chúng lớn hơn năng lượng ion hóa thứ nhất.
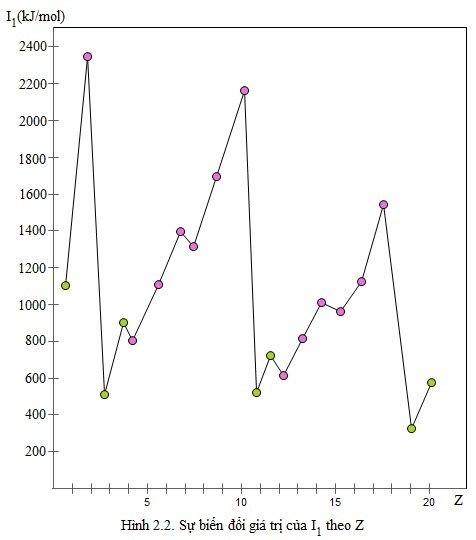
Giá trị năng lượng ion hóa thứ nhất của nguyên tử các nguyên tố nhóm A được trình bày trên bảng 2.2. Sự biến đổi năng lượng ion hóa theo Z được biểu diễn theo hình 2.2.
Bảng 2.2
Năng lượng ion hóa thứ nhất (kJ/mol) của nguyên tử các nguyên tố nhóm A.
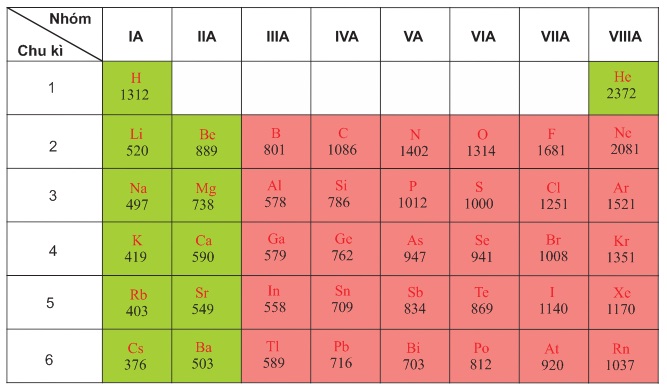
Từ bảng 2.2 và hình 2.2 cho thấy:
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, lực liên kết giữa hạt nhân và electron lớp ngoài cùng tăng, làm cho năng lượng ion hóa nói chung cũng tăng theo.
Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, khoảng cách giữa electron lớp ngoài cùng đến hạt nhân tăng, lực liên kết giữa electron lớp ngoài cùng và hạt nhân giảm, do đó năng lượng ion hóa nói chung giảm.
Thí dụ: Năng lượng ion hóa của liti(Li) bằng 520kJ/mol, còn của xesi(Cs) bằng 376kJ/mol. Xesi là nguyên tố có năng lượng ion hóa thấp nhất (không kể franxi là nguyên tố phóng xạ), dễ mất một electron trở thành ion dương Cs+, nên xesi được dùng trong tế bào quang điện.
Vậy: Năng lượng ion hóa thứ nhất của nguyên tử các nguyên tố nhóm A biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
III. ĐỘ ÂM ĐIỆN
Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
Như vậy, độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim của nguyên tố đó càng mạnh. Ngược lại, độ âm điện của nguyên tử nguyên tố càng nhỏ thì tính kim loại nguyên tố đó càng mạnh.
Trong hóa học, có nhiều thang độ âm điện khác nhau do các tác giả tính toán dựa trên những cơ sở khác nhau. Dưới dây giới thiệu bảng giá trị độ âm điện của nhà hóa học Pau-linh (L.Pauling) thiết lập năm 1932 . Vì nguyên tố flo là phi kim mạnh nhất, Pau-linh quy ước lấy độ âm điện của flo để xác định độ âm điện tương đối cuả nguyên tử các nguyên tố khác.
Bảng 2.3
Giá trị độ âm điện của nguyên tử một số nguyên tố nhóm A theo Pau-linh
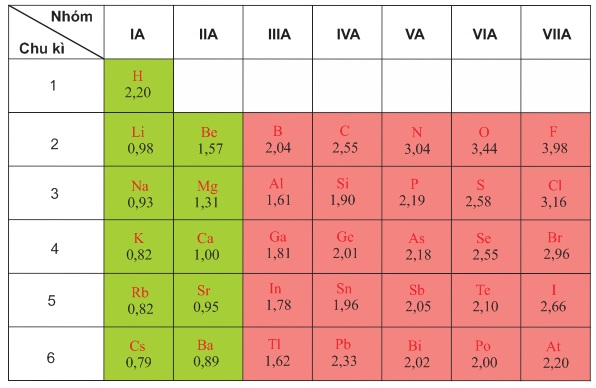
Sự biến đổi độ âm điện theo Z được biểu diễn trên hình 2.3.
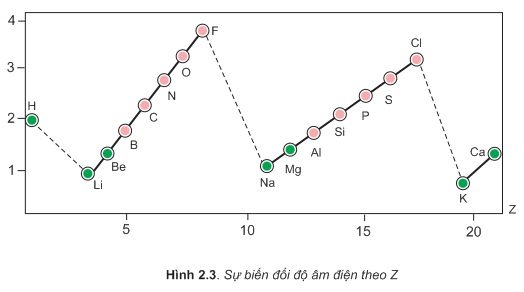
Từ bảng 2.3 và hính 2.3 cho thấy sự biến đổi độ âm điện của các nguyên tử nguyên tố như sau:
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố thường tăng dần.
Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố thường giảm dần.
Vậy: Độ âm điện của nguyên tử các nguyên tố nhóm A biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.

.jpg)
.jpg)




.jpg)
.jpg)




















