A- KIM LOẠI
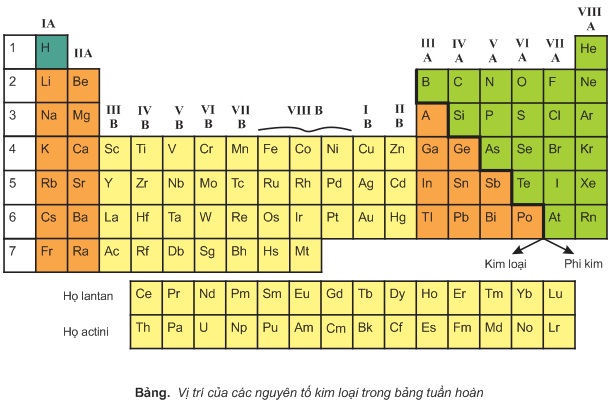
I- VỊ TRÍ CỦA KIM LOẠI TRONG BẢNG TUẦN HOÀN
Trong bảng tuần hoàn, các nguyên tố kim loại có mặt ở:
- Nhóm IA (trừ nguyên tố hiđro) và IIA. Các kim loại này là những nguyên tố s
- Nhóm IIA (trừ nguyên tố bo), một phần các nhóm IVA,VA,VIA. Các kim loại này đều là những nguyên tố p.
- Các nhóm B (từ IB đến VIIIB). Kim loại các nhóm B được gọi là những kim loại chuyển tiếp, chúng là những nguyên tố d.
- Họ lantan và actini. Các kim loại thuộc hai họ này là những nguyên tố f. Chúng được xếp riêng thành hai hàng ở cuối bảng.
Như vậy, các nguyên tố kim loại có mặt trong hầu hết các nhóm nguyên tố. Trong hơn 110 nguyên tố mà ngày nay đã biết, có tới khoảng 90 nguyên tố là kim loại.
II- TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI
1. Tính chất chung
Kim loại có những tính chất vật lí chung là: tính dẻo, tính dẫn điện, tính dẫn nhiệt và ánh kim.
a) Tính dẻo
Khi tác dụng một lực cơ học đủ mạnh lên miếng kim loại, nó bị biến dạng. Sự biến dạng này là do các cation kim loại trong mạng tinh thể trượt lên nhau, nhưng không tách rời nhau là nhờ lực hút tĩnh điện của các electron tự do với các cation kim loại trong mạng tinh thể. Do vậy kim loại có tính dẻo.
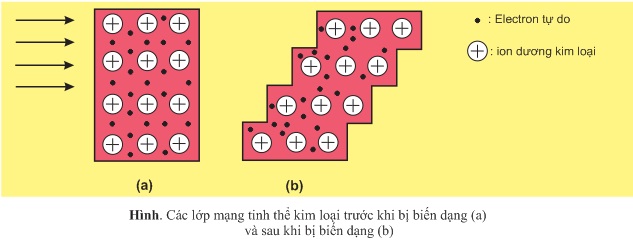
Những kim loại có tính dẻo cao là Au,Ag,Al,Cu,Sn,.... Người ta có thể dát được những lá vàng mỏng tới 1/20 micromet (1 micromet bằng 1/1000mm), ánh sáng có thể đi qua được.
b) Tính dẫn điện
Nối một sợi dây kim loại với nguồn điện, các electron tự do đang chuyển động hỗn loạn trở nên chuyển động thành dòng trong kim loại. Đó là sự dẫn điện của kim loại. Nói chung nhiệt độ của kim loại càng cao thì tính dẫn điện của kim loại càng giảm. Hiện tượng này được giải thích như sau: khi tăng nhiệt độ, sự dao động của các ion kim loại tăng lên, làm cản trở sự chuyển động của dòng electron tự do trong kim loại
Những kim loại khác nhau có tính dẫn điện khác nhau chủ yếu là do mật độ electron tự do của chúng không giống nhau. Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu,Au,Al,Fe,...
Nếu quy ước độ dẫn điện của Hg là đơn vị thì độ dẫn điện của Ag là 49 của Cu là 46, của Au là 35,5, của Al là 26.
c) Tính dẫn nhiệt
Đốt nóng một đầu dây kim loại, những electron tự do ở vùng nhiệt độ cao có động năng lớn hơn, chúng chuyển động đến vùng có nhiệt độ thấp hơn của kim loại và truyền năng lượng cho các ion dương ở đây. Vì vậy, kim loại có tính dẫn nhiệt.
Nói chung, những kim loại nào dẫn điện tốt thì dẫn nhiệt cũng tốt. Tính dẫn nhiệt của kim loại giảm dần theo thứ tự Ag,Cu,Al,Fe,...
d) Ánh kim
Vẻ sáng của kim loại gọi là ánh kim. Hầu hết kim loại đều có ánh kim. Sỡ dĩ kim loại có ánh kim là do các electron tự do trong kim loại phản xạ tốt những tia sáng có bước sóng mà mắt ta có thể nhìn thấy được.
Tóm lại, những tính chất vật lí chung của kim loại như trên chủ yếu do các electron tự do trong kim loại gây ra.
2. Tính chất riêng
Ngoài ra, kim loại còn có một số tính chất vật lí riêng biệt. Quan trọng hơn cả là: khối lượng riêng, nhiệt độ nóng chảy, tính cứng của kim loại,...
a) Khối lượng riêng
Những kim loại khác nhau có khối lượng riêng khác nhau rõ rệt. Li là kim loại có khối lượng riêng nhỏ nhất, D=0,5g/cm3. Kim loại có khối lượng riêng lớn nhất là osimi (Os),D=22,6g/cm3.
Người ta quy ước, những kim loại có khối lượng riêng nhỏ hơn 5g/cm3 là những kim loại nhẹ như: Na,K,Mg,Al,... Những kim loại có khối lượng riêng lớn hơn 5g/cm3 là những kim loại nặng, như: Fe,Zn,Pb,Cu,Ag,Hg,...
b) Nhiệt độ nóng chảy
Những kim loại khác nhau có nhiệt độ nóng chảy rất khác nhau. Có kim loại nóng chảy ở nhiệt độ thấp, như Hg nóng chảy ở −39oC, nhưng có kim loại nóng chảy ở nhiệt độ cao, như W (vonfam) nóng chảy ở 3410oC.
c) Tính cứng
Những kim loại khác nhau có tính cứng rất khác nhau. Có kim loại mềm như sáp, dùng dao cắt được dễ dàng như Na,K,...Ngược lại có kim loại rất cứng không thể dũa được, như W,Cr,...
Nếu chia độ cứng của chất rắn thành 10 bậc và quy ước độ cứng của kim cương là 10, thì độ cứng của một số kim loại như sau: Cr là 9, W là 7, Fe là 4,5, Cu và Al là 3. Kim loại có độ cứng thấp nhất là các kim loại thuộc nhóm IA, thí dụ Cs có độ cứng là 0,2.
Nhìn chung, một số tính chất vật lí của kim loại như khối lượng riêng, nhiệt độ nóng chảy, tính cứng phụ thuộc vào độ bền của liên kết kim loại, nguyên tử khối, kiểu mạng tinh thể,...của kim loại.
III- TÍNH CHẤT HÓA HỌC CHUNG CỦA KIM LOẠI.
Từ những đặc điểm về cấu hình electron, độ âm điện, năng lượng ion hóa của nguyên tử kim loại, ta nhận thấy tính chất hóa học đặc trưng của kim loại là tính khử. Nói cách khác, nguyên tử kim loại dễ bị oxi hóa thành ion dương: M→Mn++ne
1. Tác dụng với phi kim
Hầu hết các kim loại khử được phi kim thành ion âm.
Thí dụ:
4Al+3O2→to 2Al2O3
Cu+Cl2→to CuCl2
2. Tác dụng với axit
a) Đối với dung dịch HCl,H2SO4 loãng
Nhiều kim loại có thể khử được ion H+(H3O+) của các axit này thành H2.
Thí dụ:
Zn+H2SO4→ZnSO4+H2↑
Zn+2H+→Zn2++H2↑
Những kim loại có tính khử mạnh như K,Na,... sẽ gây nổ khi tiếp xúc với các dung dịch axit.
b) Đối với H2SO4 (đặc, nóng), HNO3
Hầu hết các kim loại (trừ Pt,Au) khử được N+5 và S+6 trong các axit này xuống số oxi hóa thấp hơn:
N+4(NO2);N+2(NO);N+1(N2O);N20;N−3(NH+4);S+4(SO2);S0;S−2(H2S)
Thí dụ:
.png)
3. Tác dụng với dung dịch muối
Kim loại hoạt động có thể khử được ion kim loại kém hoạt động hơn trong dung dịch muối thành kim loại tự do.
Thí nghiệm: Fe tác dụng với dung dịch CuSO4. Cho dung dịch CuSO4 chảy chậm qua lớp mạt sắt
Quan sát hiện tượng: Giải thích.
Phương trình hóa học của phản ứng:
Fe0+Cu+2SO4→Fe+2SO4+Cu0↓
4. Tác dụng với nước
- Những kim loại có tính khử mạnh như Na,K,Ca,... khử H2O dễ dàng ở nhiệt độ thường.
Thí dụ:
2Na+2H2O→2NaOH+H2↑
- Một số kim loại có tính khử trung bình, như Zn,Fe,... khử được hơi nước ở nhiệt độ cao.
Thí dụ:
3Fe+4H2O→to Fe3O4+4H2↑
- Những kim loại có tính khử yếu như Cu,Ag,Hg,... không khử được H2O, dù ở nhiệt độ cao.
B- HỢP KIM
I- ĐỊNH NGHĨA
Hợp kim là vật liệu kim loại có chứa một vật liệu cơ bản và một số kim loại hoặc phi kim khác.
Thí dụ: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác. Đuyra là hợp kim của nhôm với đồng, mangan, magie, silic.
II- TÍNH CHẤT CỦA HỢP KIM
Tính chất của hợp kim phụ thuộc vào thành phần các đơn chất tham gia cấu tạo mạng tinh thể của hợp kim. Nhìn chung, hợp kim có nhiều tính chất hóa học tương tự như của các đơn chất tham gia thành hợp kim, nhưng tính chất vật lí và tính chất cơ học của hợp kim lại khác rất nhiều so với tính chất các đơn chất.
Thí dụ:
- Hợp kim không bị ăn mòn: Fe−Cr−Mn (thép inoc),...
- Hợp kim siêu cứng: W−Co,Co−Cr−W−Fe,...
- Hợp kim có nhiệt độ nóng chảy thấp: Sn−Pb (thiếc hàn nóng chảy ở 2100C), có hợp kim gồm Bi−Pb−Sn nóng chảy ở 65oC.
- Hợp kim nhẹ, cứng và bền Al−Si,Al−Cu−Mn−Mg
III- ỨNG DỤNG CỦA HỢP KIM
Ngày nay con người có thể chế tạo ra được nhiều hợp kim có những tính chất hóa học, vật lí và cơ học rất quý, nên hợp kim được sử dụng rỗng rãi trong các ngành kinh tế quốc dân.
Ngành công nghiệp chế tạo máy bay, ôtô, tên lửa , tàu vũ trụ cần những hợp kim nhẹ, bền, chịu được nhiệt độ cao và áp suất lớn. Ngành công nghiệp dầu mỏ, công nghiệp hóa chất cần những hợp kim có tính bền hóa học và cơ học cao.Thép được dùng rộng rãi trong xây dựng và chế tạo máy. Các đồ dùng gia đình thường được dùng bằng các hợp kim không gỉ, vẻ sáng đẹp và không độc hại,...

.jpg)
.jpg)




.jpg)
.jpg)




















