I. AXIT CACBONIC (H2CO3)
1. Trạng thái tự nhiên và tính chất vật lí
- Nước tự nhiên và nước mưa có hòa tan khí cacbonic (CO2):1000 cm3 nước hòa tan được 90cm3 khí CO2, một phần khí CO2 tác dụng với H2O tạo thành H2CO3, phần lớn vẫn tồn tại ở dạng khí cacbonic trong khí quyển.
CO2 + H2O ⇌ H2CO3 (phản ứng thuận nghịch)
2. Tính chất hóa học
- H2CO3 là một axit yếu: dung dịch H2CO3 làm quỳ tím chuyển thành màu đỏ nhạt.
- H2CO3 là một axit không bền: khi đun nóng thì khí CO2 tách ra khỏi dung dịch; khi tham gia các phản ứng hóa học thì nhanh chóng bị phân hủy thành CO2 và H2O.
II. MUỐI CACBONAT
1. Phân loại
- Có 2 loại muối: muối cacbonat trung hòa và muối cacbonat axit.
+ Muối cacbonat trung hòa được gọi là muối cacbonat: natri cacbonat (Na2CO3), magie cacbonat (MgCO3), canxi cacbonat (CaCO3)...
+ Muối cacbonat axit được gọi là muối hiđrocacbonat: natri hiđrocacbonat (NaHCO3), canxi hiđrocacbonat Ca(HCO3)2, ...
2. Tính chất
a) Tính tan
Đa số muối cacbonat không tan trong nước trừ một số muối cacbonat của kim loại kiềm như Na2CO3 ,
K2CO3 ...
Hầu hết muối hyđrocacbonat tan trong nước như: Ca(HCO3)2
.png)
3. Ứng dụng
- CaCO3 là thành phần chính của đá vôi, được dùng làm nguyên liệu sản xuất vôi, xi măng.
- Na2CO3 được dùng để nấu xà phòng, thủy tinh.
- NaHCO3 được dùng làm dược phẩm, hóa chất trong bình cứu hỏa.
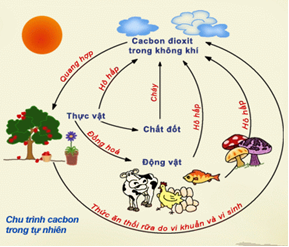
III. CHU TRÌNH CACBON TRONG TỰ NHIÊN
Trong tự nhiên luôn có sự chuyển hoá cacbon từ dạng này sang dạng khác. Sự chuyển hoá này diễn ra thường
xuyên, liên tục và tạo thành chu trình khép kín.
1. H2CO3 là axit yếu, không bền,dễ bị phân hủy thành CO2 và H2O.
2. Muối cacbonat có những tính chất hóa học sau: tác dụng với dung dịch axit mạnh, với dung dịch bazo, dung dịch muối; dễ bị nhiệt phân hủy giải phóng khí CO2 ( Trừ Na2CO3, K2CO3..)
3. Một số muối cacbonat được dùng làm nguyên liệu sản xuất vôi, xi măng, xà phòng, thuốc chữa bệnh, bình cứu hỏa,v.v,...

.jpg)
.jpg)




.jpg)
.jpg)




















