I- VỊ TRÍ VÀ CẤU TẠO
1. Vị trí cả kim loại kiềm thổ trong bảng tuần hoàn
Kim loại kiềm thổ nhóm IIA của bảng tuần hoàn, gồm các nguyên tố: beri (Be), magie (Mg), canxi (Ca), stronti (Sr), bari (Ba) và rađi (Ra). Trong mỗi chu kì, nguyên tố kim loại kiềm thổ đứng sau nguyên tố kim loại kiềm.
2. Cấu tạo và tính chất của kim loại kiềm thổ
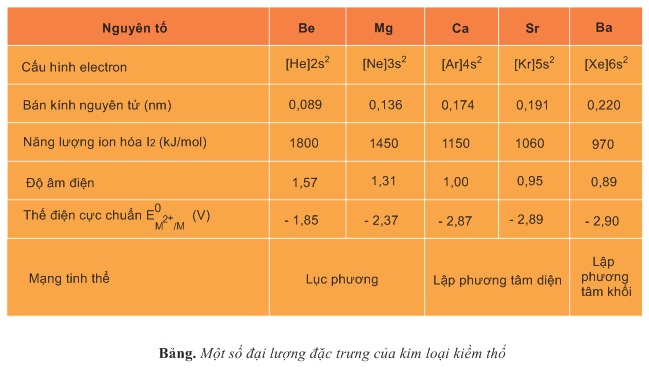
Cấu hình electron: Kim loại kiềm thổ là những nguyên tố s. Lớp ngoài cùng của nguyên tử có 2e ở phân lớp ns2. So với những electron khác trong nguyên tử thì hai elcetron ns2 ở xa hạt nhân hơn cả, chúng dễ tách khỏi nguyên tử.
Các cation M2+ của kim loại kiềm thổ có cấu hình electron của nguyên tử khí hiếm đứng trước nó trong bảng tuần hoàn.
Thí dụ:
Mg → Mg2++2e
[Ne]3s2 [Ne]
Ca → Ca2++2e
[Ar]4s2 [Ar]
Số oxi hóa: Các ion kim loại kiềm thổ có điện tích duy nhất là 2+. Vì vậy trong các hợp chất, nguyên tố kim loại kiềm thổ có số oxi hóa là +2.
Thế điện cực chuẩn: Các cặp oxi hóa - khử M2+/M của kim loại kiềm thổ đều có thế điện cực chuẩn rất âm.
II- TÍNH CHẤT VẬT LÍ
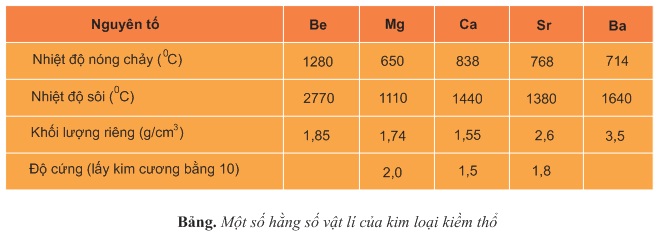
Tính chất vật lí của các kim loại kiềm thổ được tóm tắt ở bảng dưới.
Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp (trừ beri).
Độ cứng tuy có cao hơn kim loại kiềm, nhưng nhìn chung kim loại kiềm thổ có độ cứng thấp.
Khối lượng riêng tương đối nhỏ, chúng là những kim loại nhẹ hơn nhôm (trừ bari).
III- TÍNH CHẤT HÓA HỌC
Các kim loại kiềm thổ đều có tính khử mạnh, nhưng yếu hơn so với kim loại kiềm. Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba.
1. Tác dụng với phi kim
Khi đốt nóng, các kim loại kiềm thổ đều bốc cháy trong không khí tạo ra oxit.
Thí dụ:
2Mg+O2→to 2MgO
Tác dụng với halogen tạo muối halogenua.
Thí dụ:
Ca+Cl2→to CaCl2
2. Tác dụng với axit
Các kim loại kiềm thổ đều có thế điện cực rất âm (E0M2+/M từ−2,90Vđến−1,85V) vì vậy chúng đều khử được H+ trong các dung dịch axit (H2SO4 loãng,HCl) thành khí hiđro.
Thí dụ:
Ca+2HCl→CaCl2+H2↑
3. Tác dụng với nước
Ca,Sr,Ba tác dụng với H2O ở nhiệt độ thường tạo thành dung dịch bazơ. Mg tác dụng chậm với nước ở nhiệt độ thường tạo ra Mg(OH)2, tác dụng nhanh với hơi nước ở nhiệt độ cao thành MgO.Be không tác dụng với H2O dù ở nhiệt độ cao.
Ca+2H2O→Ca(OH)2+H2↑
Mg+H2O→to MgO+H2↑
IV- ỨNG DỤNG VÀ ĐIỀU CHẾ
1. Ứng dụng của kim loại kiềm thổ
Kim loại Be được dùng làm chất phụ gia để chế tạo những hợp kim có tính đàn hồi cao, bền chắc, không bị ăn mòn.
Kim loại Mg có nhiều ứng dụng hơn cả. Nó được dùng để chế tạo những hợp kim có đặc tính cứng, nhẹ, bền. Những hợp kim này được dùng để chế tạo máy bay, tên lửa, ôtô,...Kim loại Mg còn được dùng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm.
Kim loại Ca dùng làm chất khử để tách oxi, lưu huỳnh ra khỏi thép. Canxi còn được dùng để làm khô một số hợp chất hữu cơ.
2. Điều chế kim loại kiềm thổ
Trong tự nhiên, kim loại kiềm thổ chỉ tồn tại ở dạng ion Mg2+ trong các hợp chất. Phương pháp cơ bản điều chế kim loại kiềm thổ là điện phân muối nóng chảy của chúng.
Thí dụ:
CaCl2→đpnc Ca+Cl2↑
MgCl2→đpnc Mg+Cl2↑

.jpg)
.jpg)




.jpg)
.jpg)










