Công thức: C2H4
Điểm nóng chảy: -169,2 °C
Mật độ: 1,18 kg/m³
Điểm sôi: -103,7 °C
Phân tử khối: 28
Phân loại: Anken, Hợp chất hữu cơ
I. TÍNH CHẤT VẬT LÍ
- Là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
II. CẤU TẠO PHÂN TỬ
-Công thức cấu tạo
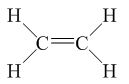
- Công thức thường được viết gọn là CH2=CH2
- Trong phân tử etilen C2H4, có 4 liên kết đơn C-H và một liên kết đôi C=C. Liên kết đôi C=C kém bền, liên kết này dễ đứt ra trong các phản ứng hóa học.
- Giữa 2 nguyên tử C có 2 liên kết, những liên kết như vậy gọi là liên kết đôi.
- Trong liên kết đôi có một liên kết kém bền, liên kết này dễ bị đứt ra trong các phản ứng hoá học
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi
- Khi đốt khí etilen cháy trong oxi thì tạo thành khí CO2 và H2O, phản ứng tỏa nhiều nhiệt.
C2H4(k) + 3O2(k) -> 2CO2(k) + 2H2O(h) (điều kiện nhiệt độ)
2. Phản ứng cộng
- Do trong phân tử etilen có một liên kết đôi C=C kém bền, dễ bị đứt ra khi tham gia phản ứng hóa học nên etilen có thể tham gia phản ứng kết hợp với khí hi đro hoặc dung dịch brom. Các phản ứng này được gọi là phản ứng cộng.
Tác dụng với dung dịch brom
- Khi dẫn khí etilen đi qua dung dịch nước brom thì dung dịch dần dần bị nhạt màu rồi mất hẳn.
CH2 = CH2(k) + Br2(dd) → CH2Br-CH2Br (l) (l: lỏng)
- Ngoài brom, trong những điều kiện thích hợp, etilen còn có phản ứng cộng vởi một số chất khác như: Cl2, HCl, H2O...
3. Phản ứng trùng hợp
- Khi có xúc tác và nhiệt độ thích hợp, liên kết kém bền trong phân tử etilen bị dứt ra làm cho các phân tử etilen kết hợp với nhau, tạo thành chất có phân tử lượng rất lớn gọi là polietilen. Phản ứng đó gọi là phản ứng trùng hợp
... + CH2=CH2 + CH2=CH2 + CH2=CH2 +..... -> ... -CH2-CH2-CH2-CH2-CH2-CH2- ... (xúc tác, áp suất, nhiệt độ)
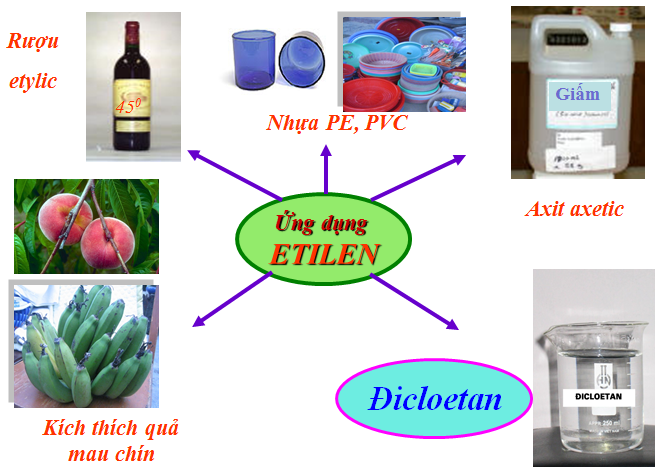
IV. ỨNG DỤNG
- Etilen dùng để sản xuất axit axetic, rượu etylic, poli (vinyl clorua),...
- Etilen dùng kích thích quả mau chín. (Vì khí etilen có tác dụng xúc tiến hô hấp của tế bào trái cây, từ đó làm cho trái cây chín nhanh hơn)

.jpg)
.jpg)




.jpg)
.jpg)




















