I. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HÓA HỌC
1. Phản ứng một chiều
Là phản ứng chỉ xảy ra theo 1 chiều từ trái sang phải
Ví dụ: 2KClO3 → 2KCl + 3O2
2. Phản ứng thuận nghịch
Là những phản ứng trong cùng điều kiện xảy ra theo 2 chiều trái ngược nhau.
Vd : Cl2 + H2O ⥩ HCl + HClO
3. Cân bằng hóa học
Định nghĩa: Cân bằng hóa học trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Cân bằng hóa học là một cân bằng động.
Ở trạng thái cân bằng thì trong hệ luôn luôn có mặt chất phản ứng và các chất sản phẩm
II. SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
Định nghĩa : Sự chuyển dịch cân bằng hóa học là sự dịch chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động từ các yếu tố bên ngoài lên cân bằng
III. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
1. Ảnh hưởng của nồng độ
![]()
Khi tăng nồng độ của CO2 → Cân bằng chuyển dịch theo chiều thuận (nhằm làm giảm nồng độ CO2)
Khi giảm nồng độ của CO2 → Cân bằng chuyển dịch theo chiều nghịch (nhằm làm tăng nồng độ CO2)
Kết luận: Khi tăng nồng độ của một chất cân bằng hóa học chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
Lưu ý: Nếu trong hệ cân bằng có chất rắn tham gia, thì việc thêm hoặc bớt chất rắn không ảnh hưởng gì tới cân bằng.
2. Ảnh hưởng của áp suất
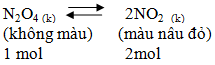
Khi tăng áp suất→Cân bằng chuyển dịch theo chiều nghịch (nhằm làm giảm áp suất tức làm giảm số mol khí)
Khi giảm áp suất→Cân bằng chuyển dịch theo chiều thuận (nhằm làm tăng áp suất tức tăng số mol khí)
Kết luận: Khi tăng áp suất của hệ cân bằng hóa học chuyển dịch theo chiều làm giảm áp suất (tức làm giảm số mol khí) và ngược lại.
3. Ảnh hưởng của nhiệt độ
Phản ứng thu nhiệt : ∆H >0 (làm nhiệt độ giảm)
Phản ứng tỏa nhiệt : ∆H <0 (làm nhiệt độ tăng)
Khi tăng nhiệt độ→Cân bằng chuyển dịch theo chiều thuận (chiều thu nhiệt nhằm làm giảm nhiệt độ).
Khi giảm nhiệt độ→Cân bằng chuyển dịch theo chiều nghịch (chiều tỏa nhiệt nhằm làm tăng nhiệt độ).
Kết luận:
Khi tăng nhiệt độ cân bằng hóa học chuyển dịch theo chiều thu nhiệt (nhằm làm giảm nhiệt độ).
Khi giảm nhiệt độ cân bằng hóa học chuyển dịch theo chiều tỏa nhiệt (nhằm làm tăng nhiệt độ).
4. Vai trò của chất xúc tác
Chất xúc tác không làm chuyển dịch cân bằng hóa học.
Khi phản ứng thuận nghịch chưa ở trạng thái cân bằng thì chất xúc tác có tác dụng làm cho cân bằng nhanh chóng được thiết lập hơn.
IV. Ý NGHĨA CỦA TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC TRONG SẢN XUẤT HÓA HỌC
Ví dụ 1: 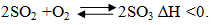
Để thu được nhiều SO3 phải:
Tăng nồng độ O2 bằng cách dùng dư không khí.
Nếu giảm nhiệt độ thì tốc độ phản ứng xảy ra chậm do đó phải thực hiện ở nhiệt độ hợp lí là 450-5000C và dùng thêm chất xúc tác là V2O5
Ví dụ 2: 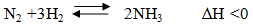
Để thu được nhiều NH3 phải:
Thực hiện ở áp suất cao.
Nếu giảm nhiệt độ thì tốc độ phản ứng xảy ra chậm do đó phải thực hiện ở nhiệt độ hợp lí là 450-5000C và dùng thêm chất xúc tác là Fe, K2O và Al2O3.

.jpg)
.jpg)




.jpg)
.jpg)




















