I - KHÁI NIỆM VỀ LIÊN KẾT HÓA HỌC
1. Khái niệm về liên kết
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Khi có sự chuyển các nguyên tử riêng rẽ thành phân tử hay tinh thể tức là có liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
Một cách tổng quất, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng sự giảm năng lượng khi chuyển các nguyên tử riêng rẽ thành phân tử hay tinh thể.
2. Quy tắc bát tử (8 electron)
Ta đã biết, các khí hiếm hoạt động hóa học rất kếm, chúng tồn tại trong tự nhiên dưới dạng nguyên tử tự do riêng rẽ, nguyên tử của chúng không liên kết với nhau mà tạo thành phân tử.
Trong các nguyên tử khí hiếm, nguyên tử heli chỉ có 2 electron nên có 2 electron ở lớp thứ nhất cũng là lớp ngoài cùng, còn các nguyên tử khí hiếm khác để có 8 electron ở lớp ngoài cùng. Như vậy, cấu hình với 8 electron ở lớp ngoài cùng (hoặc 2 electron đối với heli) là cấu hình electron vững bền.
Theo quy tắc bát tử (8 electron) thì nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron vững bền của các khí hiếm với 8 electron (hoặc 2 đối với heli) ở lớp ngoài cùng.
Với quy tắc bát tử, người ta có thể giải thích một cách định tính sự hình thành các loại liên kết trong phân tử, đặc biệt là cách viết công thức cấu tạo trong các hợp chất thông thường.
Vì phân tử là một hệ phức tạp nên trong nhiều trường hợp quy tắc bát tử tỏ ra không đầy đủ.
II - LIÊN KẾT ION
1. Sự hình thành ion
a) Ion
Trong nguyên tử, số proton bằng số electron nên nguyên tử trung hòa điện. Trong phản ứng hóa học, nếu nguyên tử mất bớt hoặc thu thêm electron, nó sẽ trở thành phần tử mang điện tích dương hoặc âm. Nguyên tử hoặc nhóm nguyên tử mang điện được gọi là ion.
Ion dương (hay cation):
Ta xét sự hình thành ion natri từ nguyên tử natri: Nguyên tử natri có cấu hình electron: 1s22s22p63s1 và năng lượng hóa I1 nhỏ nên dễ mất một electron ở lớp ngoài cùng để trở thành ion mang một đơn vị điện tích dương. Ta có thể biểu diễn quá trình đó như sau: Na→Na++e
Các nguyên tử kim loại dễ nhường 1,2,3 electron ở lớp ngoài cùng để trở thành các ion mang 1,2,3 đơn vị điện tích dương. Thí dụ:
Mg→Mg2++2e
Al→Al3++3e
Ion mang điện tích dương được gọi là ion dương hay cation. Người ta gọi tên cation kim loại bằng cách đặt trước tên kim loại từ "cation" như cation liti (Li+), cation magie Mg2+, cation nhôm (Al3+), cation đồng I(Cu+), cation đồng II(Cu2+),...
Ion âm (hay anion):
Ta xét sự hình thành ion flo từ nguyên tử flo: Nguyên tử flo có cấu hình electron: 1s22s22p5 và có độ âm điện lớn nên flo dễ thu thêm một electron để trở thành ion mang một đơn vị điện tích âm. Ta có thể biểu diễ quá trình đó như sau: F+e→F−
Các nguyên tử halogen khác và các nguyên tử phi kim như O,S có thể thu thêm 1,2 electron và trở thành các ion âm.Thí dụ:
Cl+e→Cl−
O+2e→O2−
S+2e→S2−
Ion mang điện tích âm được gọi là ion âm hay anion. Người ta thường gọi tên các anion bằng tên gốc axit tương ứng, thí dụ các ion F−,Cl−,S2− lần lượt được gọi là ion florua, clorua, sunfua. Ion O2− được gọi là ion oxit.
b) Ion đơn và ion đa nguyên tử
Ion đơn nguyên tử là ion được tạo nên từ một nguyên tử. Thí dụ: Li+,Mg2+,Al3+,Cu2+,F−,Cl−,S2−,...
Ion đa nguyên tử là ion được tạo nên từ nhiều nguyên tử liên kết với nhau để thành một nhóm nguyên tử mang điện tích dương hay âm. Thí dụ, ion amoni (NH+4), các ion gốc axit như ion nitrat (NO−3), ion sunfat (SO2−4), ion photphat PO3−4...
2. Sự hình thành liên kết ion
a) Sự tạo thành liên kết ion của phân tử 2 nguyên tử
Xét sự hình thành liên kết ion trong phân tử natri clorua (NaCl) .
Do đặc điểm cấu tạo nguyên tử và theo quy tắc bát tử, khi các nguyên tử Na và Cl tiếp xúc với nhau sẽ có sự nhường và nhân electron để trở thành các ion Na+ và Cl−, có cấu hình electron nguyên tử giống cấu hình electron nguyên tử của các khí hiếm Ne và Ar. Các ion Na+ và Cl− được tạo thành có điện tích trái dấu, hút nhau tạo nên liên kết ion trong phân tử cũng như trong tinh thể NaCl.
Sự hình thành liên kết ion trong phân tử NaCl có thể tóm tắt bằng sơ đồ sau:
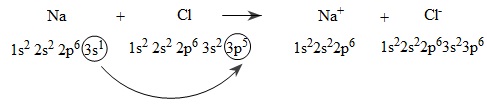
Hai ion được tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl:
Na++Cl−→NaCl
b) Sự tạo thành liên kết ion trong phân tử nhiều nguyên tử
Thí dụ: Phân tử CaCl2.
Tương tự như sự hình thành phân tử NaCl, sự hình thành liên kết ion trong phân tử CaCl2 có thể biểu diễn bằng sơ đồ sau:
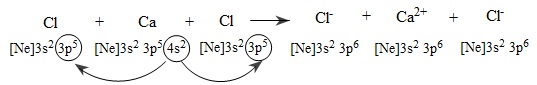
Các ion Ca2+ và Cl− tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử CaCl2:
Ca2++2Cl−→CaCl2
Vậy: Liên kết ion là liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Liên kết ion được hình thành giữa kim loại điển hình và phi kim điển hình.
III - TINH THỂ VÀ MẠNG TINH THỂ ION
1. Khái niệm về mạng tinh thể
Tinh thể được cấu tạo từ những nguyên tử, hoặc ion, hoặc phân tử. Các hạt này được sắp xếp một cách đều đặn, tuần hoàn theo một trật tự nhất định trong không gian tạo thành mạng tinh thể. Các tinh thể thường có hình dạng không gian xác định.
2. Mạng tinh thể ion
Xét mạng tinh thể NaCl:
Mạng tinh thể NaCl có cấu trúc hình lập phương. Các ion Na+ và Cl− nằm ở các nút của mạng tinh thể một cách luân phiên. Trong tinh thể NaCl, cứ một ion Na+ được bao quanh bởi 6 ion Cl−. Ngược lại, một ion Cl− được bao quanh bởi 6 ion Na+ (hình 3.1).
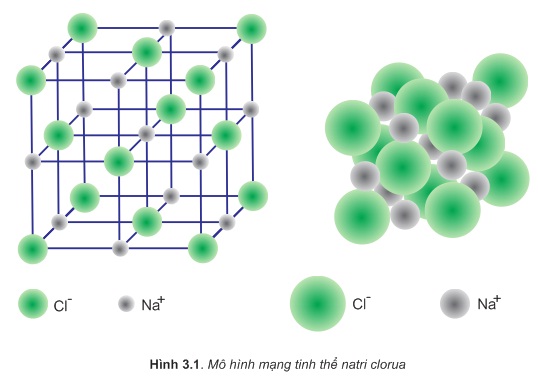
Tinh thể NaCl được tạo bởi rất nhiều ion Na+ và Cl−, không có phân tử NaCl riêng biệt. Tuy vậy khi viết công thức phân tử muối natri clorua, để đơn giản người ta chỉ viết NaCl. Tương tự đối với các hợp chất ion khác như: KCl,MgCl2,... cũng viết như vậy.
3. Tính chất chung của hợp chất ion
Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng tinh thể, có tính biền vững, thường có nhiệt độ nóng chảy và nhiệt độ sôi khá cao. Các hợp chất ion chỉ tồn tại ở dạng phân tử riêng rẽ khi chúng ở trạng thái hơi.
Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy và khi hòa tan trong nước, chúng dẫn điện, còn ở trạng thái rắn thì không dẫn điện.

.jpg)
.jpg)




.jpg)
.jpg)




















