1. Tính chất vật lí
Khác với nitơ, đơn chất photpho có thể tồn tại ở một số dạng thù hình trong đó quan trọng nhất là: photpho trắng, photpho đỏ và photpho đen.
a. Photpho trắng
Là khối trong suốt trông giống như sáp và có mạng lưới lập phương. Kiến trúc của mạng lưới đó bao gồm những phân tử P4 liên kết với nhau bằng lực Van de Van. Là chất có mạng lưới phân tử, photpho trắng dễ nóng chảy (nđnc là 44oC), dễ bay hơi (ndds là 257oC), mềm và dễ tan trong các dung môi không cực như CS2, benzen. Trạng thái hơi và trạng thái dung dịch của photpho trắng cũng gồm những phân tử P4. Phân tử P4 có cấu tạo hình tứ diện đều với các nguyên tử P nằm ở đỉnh. Hơi của photpho trắng có mùi tỏi và có thể chưng cất ở 100oC cùng với hơi nước. Người ta lợi dụng tính chất này để tinh chế photpho.
Ở 700oC, phân tử P4 bắt đầu phân hủy thành phân tử P2 và ở 1700oC phân hủy khoảng 50%. Phân tử P2 có cấu tạo giống như phân tử N2. Ở trên 2000oC phân tử P2 phân hủy thành nguyên tử. Photpho trắng không bền, dưới tác dụng của ánh sáng hoặc nhiệt, nó chuyển dần sang một dạng bền hơn là photpho đỏ. Chính cũng vì liên kết P-P trong P4 kém bền, photpho trắng rất hoạt động về mặt hóa học. Vì quá trình chuyển từ P trắng sang P đỏ xảy ra dễ dàng, photpho trắng thường có màu vàng nhạt và còn được gọi là photpho vàng. Qúa trình chuyển photpho trắng sang photpho đỏ có thể thực hiện trong vài chục giờ ở nhiệt độ 250oC. Phản ứng có thể tăng lên hanh chóng khi có một ít iot làm chất xúc tác. photpho hết sức độc, liều lượng làm chết người là 0,1g.
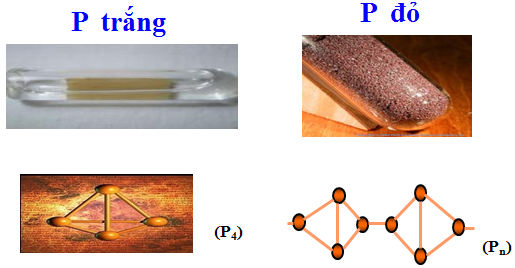
b. Photpho đỏ (hay còn gọi là photpho tím) là chất bột màu đỏ. Dưới áp suất, nó nóng chảy ở 600oC và dưới áp suất cao hơn, nó thăng hoa ở cùng nhiệt độ đó tạo thành hơi gồm những phân tử P4. Hơi này ngưng tụ lại tạo thành photpho trắng. Photpho đỏ là chất ở dạng polime, gồm một số dạng khác nhau và kiến trúc của chúng đến nay cũng chưa được xác đinh, cho nên tùy theo cách điều chế, photpho đỏ có những tính chất khác nhau, chẳng hạn như tỉ khối của chúng biến đổi từ 2,0 đến 2,4 màu sắc biến đổi từ nâu đến đỏ và tím.
c. Photpho đen được tạo nên khi đun nóng photpho trắng ở 220-370oC trong một thời gian dài (Vào khoảng 8 ngày) hoặc dưới áp suất cao (12000 atm) hoặc khi có thủy ngân làm xúc tác. Photpho đen cũng là chất polime có mạng lưới nguyên tử. Mỗi nguyên tử P liên kết với ba nguyên tử P khác bao quanh bằng liên kết cộng hóa trị với độ dài của liên kết P - P là 2,18 Angtron. Photpho đen là chất bán dẫn, nóng chảy ở gần 1000oC dưới áp suất 18.000 atm. Photpho đen bền hơn P đỏ và trắng.

Photpho đen
Photpho đen khó nóng chảy và không tan trong dung môi nào cả. Trái ngược với P trắng cả P đỏ và P đen đều không độc.
2. Tính chất hóa học
Nhận xét chung
Do liên kết trong phân tử photpho kém bền hơn trong phân tử Nit ơ nên ở điều kiện thường photpho hoạt động hóa học mạnh hơn ni tơ, mặc dù độ âm điện bé hơn.
Trong ba dạng thù hình, photpho trắng hoạt động hóa học mạnh hơn photpho đỏ và photpho đen. Để đơn giản, trong các phản ứng hóa học người ta viết phân tử photpho dưới dạng một nguyên tử P. Khi tham gia phản ứng hóa học, số oxi hóa của photpho có thể tăng từ 0 lên + 3 hoặc +5, có thể giảm từ 0 xuống -3, nên photpho thể hiện tính oxi hóa và tính khử tuy nhiên tính khử vẫn trội hơn tính oxi hóa.
a. Tính oxi hóa
Phopho chỉ thể hiện rõ rệt tính oxi hóa khi tác dụng với một số kim loại hoạt động , tạo ra muôi photphua kim loại
Thí dụ, 2P + 3Ca Ca3P2
b. Tính khử
Photpho thể hiện tính khử khi tác dụng với các phi kim hoạt động như oxi, halogen, lưu huỳnh... cũng như với các chất oxi hóa mạnh khác.
- Tác dụng với oxi
Khi đốt nóng, photpho cháy trong không khí tạo ra các oxit của photpho
Thiếu oxi: 4P + 3O2 2P2O5
Dư oxi: 4P + 5O2 2P2O5
- Tác dụng với clo
Khi cho clo đi qua photpho nóng chảy, sẽ thu được các hợp chất photpho clorua
Thiếu clo: 2P + 3Cl2 2PCl3
Dư clo: 2P + 5Cl2 2PCl5
- Tác dụng với các hợp chất
P dễ tác dụng với các hợp chất có tính oxi hóa mạnh như HNO3 đặc, KClO3, KNO3, K2Cr2O7
Thí dụ: 6P + 5KClO3 3P2O5 + 5KCl
3. Ứng dụng
Phần lớn photpho sản xuất ra được dùng để sản xuất axit photphoric, phần còn lại chủ yếu dùng trong sản xuất diêm. Ngoài ra, photpho còn được dùng vào mục đích quan sự: sản xuất bom, đạn cháy, đạn khói...

Sản xuất diêm
4. Trạng thái tự nhiên, điều chế
a. Trạng thái tự nhiên
Photpho là nguyên tố rất phổ biến trong thiên nhiên, nó chiếm khoảng 0,04% tổng số nguyên tử của vỏ Trái Đất. Photpho có vai trò rất quan trọng đối với sự sống: cùng với ni tơ, cacbon và oxi, photpho có trong protein động vật và thực vật. Photpho có ở trong những chất giữ vai trò tích cực trong quá trình sinh học quan trọng của động vật và thực vật. Photpho được cây hấp thụ từ trong đất và tích tụ lại chủ yếu ở hạt và quả. Trong động vật, Photpho tích tụ chủ yếu ở răng, xương và mô thần kinh. Photpho chiếm 1,16% khối lượng của con người. Photpho được cây hấp thụ từ trong đất ở dưới dạng muối vô cơ. Để đảm bảo sự sinh trưởng và phát triển của thực vật người ta phải bổ sung cho đất một lượng lớn phân lân (phân photpho) cùng với phân đạm, phân kali. Những thức ăn của con người chứa nhiều photpho là phomat, lòng đỏ trứng, đậu...Mỗi ngày trung bình con người cần khoảng 1- 1,2g photpho.
Trong tự nhiên không gặp photpho ở trạng thái tự do vì nó khá hoạt động về mặt hóa học. Phần lớn Photpho trong vỏ trái đất nằm ở dạng muối của axit photphoric. Hai dạng khoáng vật chính của photpho là apatit 3Ca3(PO4)2.CaF2 và photphoritCa3(PO4)2. Nước ta có mỏ apatit lớn ở Lào Cai, một số mỏ photphorit ở Thái Nguyên, Thanh Hóa.

b. Điều chế
Trong công nghiệp, photpho được sản xuất bằng cách nung hỗn hợp quặng photphorit, cát và than cốc ở 1200oC trong lò điện
Ca3(PO4)2 + 3SiO2 + 5C 3CaSiO3 + 2P + 5CO
Hơi photpho thoát ra được ngưng tụ khi làm lạnh, thu được photpho trắng ở dạng rắn.
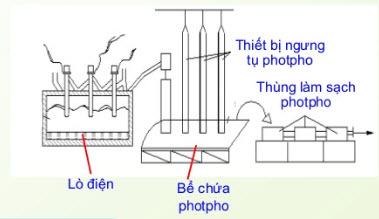
Điều chế Photpho trong công nghiệp

.jpg)
.jpg)




.jpg)
.jpg)




















